对于某些离子的检验及结论一定正确的是 ( )
| A.加入盐酸酸化无现象,再加氯化钡溶液有白色沉淀产生,一定有SO42- |
| B.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32— |
| C.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ |
| D.加入稀氢氧化钠溶液,用湿润红色石蕊试纸检验产生的气体没有变蓝,一定没有NH4+ |
室温下,CuSO4·5H2O(s)=Cu2+(aq)+SO42-(aq)+5H2O(l) ΔH1>0;
CuSO4(s)=Cu2+(aq)+SO42-(aq) ΔH2<0。
若CuSO4·5H2O受热分解的化学方程式为:CuSO4·5H2O(s)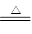 CuSO4(s) +5H2O(l),热效应为ΔH3。则下列判断正确的是
CuSO4(s) +5H2O(l),热效应为ΔH3。则下列判断正确的是
| A.ΔH1<ΔH3 | B.ΔH2>ΔH3 | C.ΔH1+ΔH3=ΔH2 | D.ΔH1+ΔH2=ΔH3 |
短周期主族元素X、Y、Z、W的原子序数依次递增。X的原子核中无中子;Y原子最外层电子数是内层的2倍;Z、W为同族元素,形成的WZ2分子是酸雨的主要成因。下列说法中正确的是
| A.X与Y形成原子个数比为1∶1的化合物只有两种 |
| B.Y、W的氧化物均为酸性氧化物 |
| C.最高价氧化物对应水化物的酸性Y<W |
| D.X与Z形成的化合物中,各原子均满足8电子稳定结构 |
下列各组物质中,不满足组内任意两种物质在一定条件下均能发生反应的是
 物质 物质组别 |
甲 |
乙 |
丙 |
| A |
Mg |
FeSO4 |
O2 |
| B |
Al2O3 |
HCl |
NaOH |
| C |
CO2 |
H2O |
Na2O2 |
| D |
NaHCO3 |
Ca(OH)2 |
Na2CO3 |
下列指定反应的离子方程式正确的是
| A.铜溶于稀硝酸:Cu+2H++NO3-=Cu2++NO2↑+H2O |
| B.氯气和水的反应:Cl2+H2O=2H++Cl-+ClO- |
| C.用氨水溶解氯化银沉淀:Ag++2 NH3·H2O=[Ag(NH3)2]++2H2O |
| D.将过量二氧化硫通入氨水中:SO2+NH3·H2O=HSO3-+NH+4 |
用 NA表示阿伏加德罗常数的数值,下列说法正确的是
| A.常温常压下,11.2 L 乙烯所含碳原子数为NA |
| B.1L 0.1 mol•L-1的Al2(SO4)3溶液中,Al3+的数目为0.2 NA |
| C.32g O2和 O3的混合气体中含有的氧原子数为2NA |
| D.5.6 g铁粉在0.1 mol氯气中充分燃烧,转移电子数为0.3NA |