应用Na2CO3和NaHCO3的下列性质设计实验,不能够鉴别Na2CO3和NaHCO3固体的是
| A.水溶性 | B.热稳定性 | C.与酸反应 | D.焰色反应 |
下列叙述中,不正确的是( )
| A.某特定反应的平衡常数仅是温度的函数 |
| B.催化剂不能改变平衡常数的大小 |
| C.平衡常数发生变化,化学平衡必定发生移动,达到新的平衡 |
| D.化学平衡发生移动,平衡常数必发生变化 |
如图所示曲线表示其他条件一定时,反应:2NO+O2 2NO2 ΔH<0,NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是( )
2NO2 ΔH<0,NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是( )
| A.a点 | B.b点 | C.c点 | D.d点 |
有一化学平衡:mA(g)+nB(g) pC(g)+qD(g)(如图)表示的是转化率与压强、温度的关系。分析图中曲线可以得出的结论是( )
pC(g)+qD(g)(如图)表示的是转化率与压强、温度的关系。分析图中曲线可以得出的结论是( )
| A.正反应吸热:m+n>p+q |
| B.正反应吸热:m+n<p+q |
| C.正反应放热:m+n>p+q |
| D.正反应放热:m+n<p+q |
可逆反应mA(g) nB(g)+pC(s) ΔH=Q,温度和压强的变化对正、逆反应速率的影响分别符合下图中的两个图象,以下叙述正确的是( )
nB(g)+pC(s) ΔH=Q,温度和压强的变化对正、逆反应速率的影响分别符合下图中的两个图象,以下叙述正确的是( )
| A.m>n,Q>0 | B.m>n+p,Q>0 |
| C.m>n,Q<0 | D.m<n+p,Q<0 |
如下图所示曲线a表示放热反应X(g)+Y(g) Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )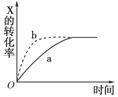
| A.升高温度 | B.加大X的投入量 |
| C.加催化剂 | D.增大体积 |