某溶液中可能含有Na+、K+、Br-、SO42-、CO32-等离子中的全部或其中的几种,现进行以下的连续操作:a.用洁净铂丝蘸取溶液在无色火焰上灼烧,火焰呈黄色;b.溶液中通入氯气,溶液由无色变为红棕色;c.溶液中加入过量的稀硫酸后,无气体放出;再加Ba(OH)2溶液后,产生白色沉淀。试填写下列空白:
⑴原混合液中一定存在的离子是______________,一定不存在的离子是_____________
⑵上述a—c的操作中,______是错误的,理由是______________________________。
⑶为确定另一种金属离子是否存在,应补充的操作是__________________。
某化学兴趣小组的同学为模拟工业制造硫酸的生产过程,设计了如图所示的装置,请根据要求回答问题:
(1)装置A用来制取氧气,写出相应的化学方程式__________________________;
(2)燃烧炉内放一定量黄铁矿粉末,在高温条件下和A装置制出的氧气充分反应,其化学方程式为 ,在该反应中____________做氧化剂;若消耗了
,在该反应中____________做氧化剂;若消耗了 有_______________mol电子发生了转移;
有_______________mol电子发生了转移;
(3)C装置为净化装置,若无该装置,将混合气体直接通入D装置,除对设备有腐蚀外,还会造成的后果是_______________________________________________;
(4)如果D装置的温度是400℃~500℃,在常压下生成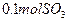 ,可放出
,可放出 的热量,请写出该反应的热化学方程式________________________________________;并回答在工业中不采取加压措施的原因_ ____________________________。
的热量,请写出该反应的热化学方程式________________________________________;并回答在工业中不采取加压措施的原因_ ____________________________。
在课堂上,老师演示了金属钠与CuSO4溶液的反应,同学们观察到该反应中生成了蓝色的Cu(OH)2沉淀而没有发现铜单质生成。但某同学想:会不会因置换生成的铜较少被蓝色沉淀所覆盖,而没有被发现呢?于是他想课后到实验室继续研究,希望进一步用实验来验证自己的猜测是否正确。
假如该同学是你,请你写一张实验准备单交给老师,要求老师提供必需的用品。
(1)实验探究目的:___________________________________________________________。
(2)探究所依据的化学原理:___________________________________________________。
(3)实验必需仪器:小刀、玻璃片、滤纸、_____________和____________;药品:金属钠、____________和____________。该同学在探究实验中意外地发现生成的蓝色沉淀中混有少量的黑色难溶物,而所使用的药品均没有问题,你认为该黑色难溶物是____________,生成该黑色难溶物的原因是________________________________________。
2007年2月16日,北京朝阳区太阳宫城管队在一出租民房内查获用工业盐制作肉制品的黑窝点。工业盐的主要成分是NaNO2。已知NaNO2能与HI反应生成NO、I2、NaI和H2O。
(1)写出上述反应的化学方程式:__________________________________________________。
(2)根据上述反应,可以用试纸和生活中常见的物质进行实验,以鉴别NaNO2和NaCl。可选用的物质有:①自来水,②KI淀粉试纸,③淀粉,④白糖,⑤食醋,⑥白酒。进行实验时,必须选用的物质是(填序号)。
已知A、B、C、D、E五种物质,且A、B、C、D的焰色反应呈黄色,它们的关系如下图所示,已知E为气体单质,能使带火星的木条复燃。
(1)写出下列物质的化学式:A____________,B____________,C____________,D____________,E____________。
(2)写出A受热分解的化学方程式:____________________________________________。
在一定温度下,把2.0体积N2和6.0体积H2通入一个带活塞的体积可变的容器中,活塞的一端与大气相通,如图所示。容器中发生的反应如下: N2+3H2 2NH3(正反应放热)
N2+3H2 2NH3(正反应放热)
若反应达到平衡后,测得混合气体为7.0体积。试回答:
(1)保持上述反应温度不变,设a、b、c(a∶b=1∶3)分别代表初始加入的N2、H2和NH3的体积,如果反应达到平衡后,混合气体中各物质的体积分数仍与上述平衡完全相同。那么:
①若a=1.0,c=2.0,则b=___________。在此情况下,反应起始时将向___________方向进行(填“正”或“逆)。
②若规定起始时反应向逆方向进行,则c的范围是_______。(用含a、b的式子表示)。
(2)在上述装置中,若需控制平衡后混合气体为6.5体积,则可采取的措施是______
原因是___________________________________。