下列有关热化学方程式的叙述正确的是
| A.反应物的总能量低于生成物的总能量时,该反应必须加热才能发生 |
| B.2H2(g)+O2(g)=2H2O(l);△H1=-akJ·mol-1,则氢气燃烧热为akJ·mol-1 |
| C.2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l) △H=-akJ·mol-1,则中和热为a/2kJ·mol-1 |
| D.N2(g)+3H2(g)=2NH3(g);△H=-akJ·mol-1,则将14gN2(g)和足量H2置于一密闭容器中,充分反应后放出0.5akJ的热量 |
下列对于25℃时pH为12的氨水,叙述正确的是( )
| A.由水电离出的c(OH-)=1.0×10-2mol·L-1 |
| B.c(NH4+)+c(NH3·H2O)=1.0×10-12mol·L-1 |
| C.与等体积、pH=2的盐酸混合后所得的溶液中:c(NH4+)>c(OH-)>c(Cl-)>c(H+) |
| D.加入一定量pH=2的醋酸溶液混合后所得的溶液中:c(CH3COO-)+c(OH-)=c(NH4+)+c(H+) |
下列反应的离子方程式正确的是( )
A.用石墨作电极电解CuCl2溶液:2Cl-+2H2O  Cl2↑+H2↑+2OH- Cl2↑+H2↑+2OH- |
B.用Na2CO3溶液作洗涤剂除油污:CO32-+2H2O H2CO3+2OH- H2CO3+2OH- |
| C.硫酸亚铁溶液与稀硫酸、双氧水混合:Fe2++2H2O2+4H+=Fe3++4H2O |
| D.向NaAlO2溶液中通入过量的CO2:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- |
用 NA表示阿伏加德罗常数的值。下列说法正确的是( )
| A.1 mol Na2O2晶体中共含有4NA个离子 |
| B.0.1 mol AlCl3完全水解转化为氢氧化铝胶体,生成0.1 NA个胶粒 |
| C.常温常压下,16 g O2和O3的混合气体中含有NA个氧原子 |
| D.电解精炼铜时每转移NA个电子,阳极溶解32 g铜 |
石灰氮(CaCN2)是一种绿色的农药和化肥,可用作除草剂、杀菌剂、杀虫剂和棉花脱叶剂,其可由CaC2(离子化合物)与N2反应制得。下列各项表达中不正确的是( )
A.C22-的电子式为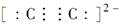 |
| B.N2的结构式为N≡N |
| C.1 mol CN22-所含的电子总数为22 mol |
D.Ca2+的结构示意图为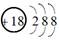 |
硫代硫酸钠(Na2S2O3)可作为脱氯剂,已知25 mL 0.1 mol/L Na2S2O3溶液恰好把224 mL(标准状况下)Cl2完全转化为Cl-,则S2O32-将转化为( )
| A.SO42- | B.SO32- | C.S | D.S2- |