氮化硅(Si3N4)是一种重要的结构陶瓷材料,属于新型功能性硅酸盐产品,它的硬度大、熔点高、化学性质稳定,工业上曾普遍采用高纯硅与纯氮在1300 ℃时反应获得。
(1)氮化硅陶瓷抗腐蚀能力强,除氢氟酸外,它不与其他无机酸反应。试推测该陶瓷被氢氟酸腐蚀的化学方程式______________________________________________。
(2)现用四氯化硅和氮气在氢气气氛保护下,加强热发生反应,可得较高纯度的氮化硅及氯化氢,反应的化学方程式为__________
(3)沸石是一种含结晶水的,具有多孔结构的铝硅酸盐,化学式为Na2[Al2Si3O10(H2O)2],若以氧化物形式可表示为 。
(4)盛装氢氧化钠溶液的试剂瓶不能用玻璃塞的原因是: (用离子方程式表示).
现有A、B、C、D、E五种溶液,只知道它们的溶质是NaHCO3、Na2CO3、NaOH、HCl、Ca(HCO3)2。为了鉴别开来,各取少量进行如下实验:
(1)A与B混合无明显现象
(2)B与C(或D,或E)混合均有无色气体产生
(3)D与A(或E)混合均有白色沉淀产生
是根据以上现象,写出A~E各物质的名称:
A;B;C;D;E。
(1)用Al2(SO4)3制取Al(OH)3,常用氨水与Al2(SO4)3反应,而不用NaOH(aq),是什么原因? ________________________________________________________________。
(2)AlCl3与NaOH溶液反应,当Al3+与OH-的物质的量之比为________时沉淀最多,________时沉淀全部溶解,________时沉淀为最多时的一半。
(3)现代科学实验证明,溶液中不存在,应为[Al(OH)-4],是沿用旧的书写习惯。请写出Al2(SO4)3溶液与过量NaOH溶液反应的化学方程式(不能用偏铝酸盐表示):______________________。
有4种钠的化合物W、X、Y、Z,它们之间存在如下关系:
①W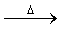 X+H2O+CO2↑
X+H2O+CO2↑
②Z+CO2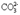 X+O2
X+O2
③Z+H2O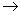 Y+O2↑
Y+O2↑
④X+Ca(OH)2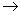 Y+CaCO3↓
Y+CaCO3↓
试回答下列问题:
(1)W、X、Y、Z的化学式分别是:W__________;X__________;Y__________;Z________。
(2)以上4个化学反应中,属于氧化还原反应的是________(填反应序号),反应中的氧化剂是________(写化学式),还原剂是________(写化学式)。
(3)若④反应在溶液中进行,写出其离子方程式以及能用该离子方程式表示的另一个化学反应的化学方程式:
①离子方程式:________________________________________________________;
②化学方程式:________________________________________________________。