汽车尾气(含有烃类、CO、SO2与NO等物质)是城市空气的污染源。冶理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂)。它的特点是使CO与NO反应,生成可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧及SO2的转化。
(1) 写出一氧化碳与一氧化氮反应的化学方程式: 。
(2) “催化转化器”的缺点是在一定程度上提高空气的酸度,其原因是
。
(3) 控制城市污染源的方法可以有 (多选扣分)
| A.开发氢能源 | B.使用电动车 | C.植树造林 | D.戴上呼吸面具 |
北京2008年奥运会金牌直径为70 mm,厚6 mm。奖牌正面为插上翅膀站立的希腊胜利女神和希腊潘纳辛纳科竞技场。奖牌背面镶嵌着取自中国古代龙纹玉璧造型的玉璧。
(1)环形玉璧由白玉制成。白玉的化学成分可简单看作是Ca2Mg5Si8O22(OH)2,将其改写成氧化物的形式为________________。
(2)为测定金牌的组成,将某去掉白玉的金牌样品,投入到过量稀硝酸中,有无色气体产生,当不再生成气体时,金牌残留一金黄色外壳;将生成的气体与11.2 L O2(标准状况)混合即呈红棕色,最后将其通入水中,所有气体完全被水吸收生成硝酸;再向金牌溶解所得的溶液中滴加氯化钠,立即产生白色沉淀;最后将残壳投入到王水中,随即溶解,生成气体的体积为1.344 L( 标准状况)。已知:Au+HNO3+4HCl===H[AuCl4]+NO↑+2H2O。
标准状况)。已知:Au+HNO3+4HCl===H[AuCl4]+NO↑+2H2O。
①该金牌所含黄金质量为________。
②该金牌除含黄金外还含有另一金属是________(填元素符号),其质量为________。
(3)黄金除能溶于王水外还能溶于氰化钾,反应方程式如下: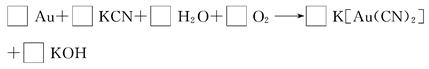
①配平该反应,并将计量数填入方框内。
②K[Au(CN)2]可作为电镀金的电镀液,金牌表面的黄金就是通过电镀镀上的。在电镀金牌时,阴极反应式为________________________________。
(9分)某混合物由NaCl、MgCl2两种物质组成,其中Na和Mg两种元素的质量比为23∶12。求:(1)NaCl与MgCl2的物质的量之比。
(2)氯离子总量为8mol时,各组分的物质的量分别是、。
根据下图所示,推断物质X的化学式,并选择适宜的物质完成图中各步转化,写出相应的化学方程式。
(1)X的化学式
(2)化学方程式:
①
②
③
④
⑤
标准状况下,①6.72 LCH4②3.01×1023HCl分子③0.2mol NH3,这三种气体按质量由大到小排列的顺序是(填物质的数字代号,下同),按氢原子数由少到多排列的顺序是,密度由大到小排列的顺序是。
下列九种物质:
①水②空气③铁④二氧化碳⑤熟石灰[Ca(OH)2]⑥胆矾(CuSO4·5H2O)⑦碱式碳酸铜[Cu2(OH)2CO3]⑧硫酸钠(Na2SO4)⑨盐酸中,属于混合物的是(填对应的数字代号),属于氧化物的是,属于盐的是,