钠、铝和铁是三种重要的金属。请回答:
(1)三种金属中,____既能与盐酸又能与氢氧化钠溶液反应,且生成物均为盐和氢气。写出该物质与氢氧化钠溶液反应的化学方程式__________________________________
(2)三种金属在一定条件下均能与水发生反应。其中,铁与水蒸气反应的化学方程式为_______________________________。
钠与水反应时可观察到的实验现象有__________(填序号)。在实验室中,通常将金属钠保存在 中;钠与水反应的化学方程式为___________________________
a. 钠沉入水底 b.钠熔成小球 c. 钠四处游动 d.溶液变为红色
已知A、B、C、D、E都是元素周期表中前36号的元素,其原子序数依次增大。A与其他4种元素既不在同一周期又不在同一族。B和C属同一主族,D和E属同一周期,又知E是周期表中1—18列中的第8列元素。D的原子序数比E小6,D跟B可形成离子化合物其晶胞结构如右图。 请回答:
请回答:
 (1)
(1) A与B形成的化合物在固态时的晶体类型是;A与B形成的化合物
A与B形成的化合物在固态时的晶体类型是;A与B形成的化合物
比A与C形成的化合物熔点要____(填高、低)
(2)
 写出C的单质与水反应的离子方程式;
写出C的单质与水反应的离子方程式;
(3)如图所示,D跟B形成的离子化合物的化学式为;鉴别该离子化合物是否为晶体,最可靠的科学方法是,该离子化合物晶体的密度为ag·cm-3,B、D两元素的相对原子质量分别为b、c,则晶胞的体积是cm3(只要求列出算式)。
(8分)⑴键线式 表示的分子式;名称是。
表示的分子式;名称是。
⑵ 中含有的官能团的名称为。
中含有的官能团的名称为。
⑶用价层电子对互斥理论推测下列分子的空间构型:
SO2 ________; HCHO___________.
⑷重结晶的首要工作是选择适当的溶剂,要求该溶剂:
a.杂质在此溶剂中溶解度______________ 。
b.被提纯的物质在此溶剂中溶解度__________________。
Mn、Fe均为第四周期过渡元素,两元素的部分电离能(I)数据列于下表:
| 元素 |
25Mn |
26Fe |
|
| 电离能/kJ·mol-1 |
I1 |
717 |
759 |
| I2 |
1509 |
1561 |
|
| I3 |
3248 |
2957 |
回答下列问题:
(1)Mn元素外围电子层的电子排布式为,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难。对此,你的解释是。
(2)Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物,则与Fe原子或离子形成配合物的分子或离子应具备的条件是。
(3)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华。易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁晶体为 晶体。
(4)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如右图所示。体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为。
有下列八种晶体:
| A.(水晶)SiO2 | B.冰醋酸 | C.氧化镁 | D.白磷 E.固体氩 |
F.氢氧化钠 G.铝 H.金刚石
用序号回答下列问题:
(1) 属于原子晶体的化合物是_________;晶体中含有氢键的是________。
(2) 由极性分子构成的晶体是_________;由正四面体形分子构成的晶体是____;
含有共价键的离子晶体是________。
(3) 在一定条件下能导电而不发生化学变化的是___________;晶体中只含有范德华
力一种作用的是___________;受热熔化需克服共价键的化合物是___________。
(每空2分,共10分)物质F是合成多种手性药物和生物活性物质的重要中间体,其合成路线如下: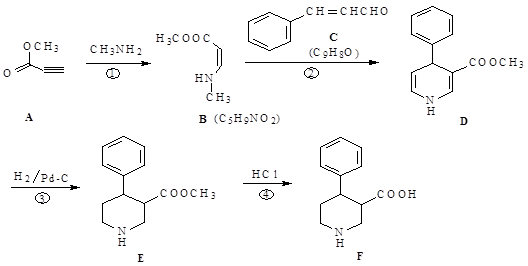
(1)反应①的类型为,反应④的类型为。
(2)物质A聚合可得聚丙炔酸甲酯,其结构简式为。
(3)物质C的俗名为肉桂醛,写出其同时满足下列条件的一种同分异构体的结构简式。
①能与氯化铁溶液显紫色;②苯环上有两个取代基;③分子的核磁共振氢谱有4个峰。
(4)若部分C被氧化为肉桂酸,反应②将产生副产物(分子式为C14H15NO3),写出其结构简式。