下列离子方程式书写不正确的是
| A.NaOH溶液与SO2反应,当n(NaOH)∶n(SO2)=4∶3时:4OH- + 3SO2 = SO32-+ 2HSO3-+ H2O |
| B.酸性条件下KIO3溶液与KI溶液发生反应生成I2:IO3-+5I-+3H2O=3I2+6OH- |
| C.AgNO3溶液中加入过量的氨水:Ag++2NH3·H2O=[Ag(NH3)2]++2H2O |
| D.1 mol·L-1的NaAlO2溶液和2.5 mol·L-1的HCl等体积互相均匀混合:2AlO2-+5H+=Al(OH)3↓+Al3++H2O |
某新型可充电电池,能长时间保持稳定的放电电压,该电池的总反应为:
则以下说法不正确的是:


| A.放电时负极反应为:Zn-2e–+2OH–=Zn(OH)2 |
| B.放电时正极反应为:FeO42–+4H2O+3e–=Fe(OH)3+5OH– |
| C.充电时阳极附近溶液的碱性减弱 |
| D.放电时每转移3 mol电子,正极有1 molK2FeO4被氧化 |
下列说法或表示方法正确的()
A.已知C(s)+O2(g)===CO2(g)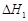 ;C(s)+ ;C(s)+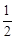 O2(g)===CO (g) O2(g)===CO (g)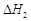 ,则 ,则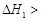 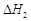 |
B.在稀溶液中,H+(aq)+OH-(aq)===H2O(l) 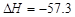 kJ·mol-1,若将含0.5molH2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热大于57.3 kJ kJ·mol-1,若将含0.5molH2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热大于57.3 kJ |
C.由C(石墨)===C(金刚石);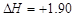 kJ·mol-1可知,金刚石比石墨稳定 kJ·mol-1可知,金刚石比石墨稳定 |
| D.已知氢气的标准燃烧热为-285.8 kJ·mol-1,相应的热化学方程式为2H2(g) + O2(g)=2H2O(l) ΔH = –285.8kJ·mol-1 |
观察下列几个装置示意图,有关叙述正确的是 ( )
| A.装置①中阳极上析出红色固体 |
| B.装置②的待镀铁制品应与电源正极相连 |
| C.装置③中外电路电子由a极流向b极 |
| D.装置④的离子交换膜允许阳离子、阴离子、水分子自由通过 |
用石墨作电极,电解1 mol/L下列物质的溶液,溶液的pH保持不变的是()
| A.HCl | B.NaOH | C. NaCl | D.Na2SO4 |
反应H2(g)+I2(g)  2HI(g)的平衡常数为K1;反应HI(g)
2HI(g)的平衡常数为K1;反应HI(g) 1/2H2(g)+1/2I2(g)的平衡常数为K2,则K1、K2的关系为(平衡常数为同温度下的测定值()
1/2H2(g)+1/2I2(g)的平衡常数为K2,则K1、K2的关系为(平衡常数为同温度下的测定值()
| A.K1=2K2 | B.K1=1/ K22 | C.K1=K22 | D.K1=1/2K2 |