(8分)在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g) CO(g)+H2O(g),
CO(g)+H2O(g),
其化学平衡常数K和温度t的关系如下表:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= 。
(2)该反应为 反应(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是 。
a、容器中压强不变 b、混合气体中 c(CO)不变
c、v正(H2)=v逆(H2O) d、c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式: c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃。
某烷烃的相对分子质量为128,其分子式为。
请根据下面给出的有关信息分析该烷烃的分子结构:
(1)从烷烃的结构看,该烷烃不能由任何一种烯烃与H2加成反应而得到,则该烷烃的结
构简式为。
(2)若该烷烃可以由一种烯烃与H2加成而得到,则符合这一要求的烷烃可以有三种不同的结构,它们的结构简式分别、、。
 写出下列反应的化学方程式,
写出下列反应的化学方程式, (1)由乙烯制备聚乙烯的反应 ;
(1)由乙烯制备聚乙烯的反应 ; (2)用苯制硝基苯的反应 ;
(2)用苯制硝基苯的反应 ;
(3)甲烷不完全燃烧生成CO和CO2的物质的量之比为2:3。
4分)按要求写出相应的化学用语:
①甲基(电子式);②氢氧根(电子式);
4分)同系物是指:相似,在分子组成上相差原子团的化合物。
乙烯是一种重要的化工原料。根据下列转化关系回答: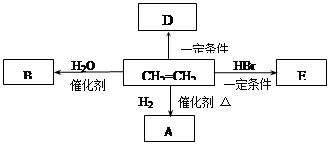
(1)乙烯分子中官能团的名称是。
(2)E的分子式是。
(3)乙烯转化成A的化学方程式是。
反应类型是。
(4)已知D是一种常见的高分子材料,写出它的结构简式