已知25℃,醋酸、次氯酸、碳酸、亚硫酸的电离平衡常数如右表,下列叙述正确的是
| 酸 |
电离平衡常数 |
| 醋酸 |
K i=1.75×10-5 |
| 次氯酸 |
K i=2.98×10-8 |
| 碳酸 |
Ki1=4.30×10-7 Ki2=5.61×10-11 |
| 亚硫酸 |
Ki1=1.54×10-2 Ki2=1.02×10-7 |
A.将0.1mol/L的醋酸加水不断稀释,c(CH3COO—)始终减小
B少量CO2通入NaClO溶液中反应的离子方程式为:CO2+H2O+2ClO—==CO32—+2HClO
C.少量的反应的离子方程式为:SO2+H2O+Ca2++2ClO—==CaSO3↓+2HClO
D.25℃,等浓度的CH3COONa、NaClO、Na2CO3和Na2SO3溶液中,碱性最强的是Na2CO3
将含有0.4mo l Cu(N03)2和0.3 mol KCl 的水溶液 1 L,用惰性电极电解一段时间后,在一个电极上析出 0.1 mol Cu ,此时要将溶液恢复到电解前溶液一样,可加入一定量的
l Cu(N03)2和0.3 mol KCl 的水溶液 1 L,用惰性电极电解一段时间后,在一个电极上析出 0.1 mol Cu ,此时要将溶液恢复到电解前溶液一样,可加入一定量的
| A.CuCl2 | B.CuO | C.Cu(OH)2 | D.CuCO3 |
物质的量浓度都为0.1mol·L-1的CH3COOH与NaOH溶液等体积混合后,下列关系式不正确的是
| A.[Na+]+[H+]=[OH-]+[CH3COO-] |
| B.[Na+]>[CH3COO-]>[H+]>[OH-] |
| C.[OH-]=[H+]+[CH3COOH] |
| D.[CH3COOH]+[CH3COO-]=[Na+] |
把Ca(OH)2固体放入一定量的蒸馏水中,有 Ca(OH)2(s) Ca2+(aq)+2OH-(aq),一定温度下达到平衡:当向悬浊液中加少量生石灰后,若温度保持不变,下列判断正确的是
Ca2+(aq)+2OH-(aq),一定温度下达到平衡:当向悬浊液中加少量生石灰后,若温度保持不变,下列判断正确的是
| A.溶液中Ca2+数目增多 | B.溶液中c(Ca2+)增大 |
| C.溶液pH值不变 | D.溶液pH值增大 |
下图是一种航天器能量储存系统原理示意图。下列说法正确的是
| A.该系统中只存在3种形式的能量转化 |
B.装置Y中负极的电极反应式为: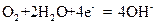 |
| C.装置X能实现燃料电池的燃料和氧化剂再生 |
D.装置X、Y形成的子系统能实现物质的零排放,并 能实现化学能与电能间的完全转化 能实现化学能与电能间的完全转化 |
已知2H2(g)+O2(g)==2H2O(l);ΔH=-569.6 kJ·mol-1,2H2O(g)==2H2(g)+O2(g);ΔH=+482.1kJ·mol-1。现有1 g液态H2O,蒸发时吸收的热量是
| A.2.43kJ | B.4.86kJ | C.43.8kJ | D.87.5 kJ |