下列叙述正确的是( )
| A.常温下,Fe、Al和浓硫酸反应不断有SO2产生,说明浓硫酸具有强氧化性 |
| B.Na的金属活动性比Mg强,故可用Na与MgCl2溶液反应制Mg |
| C.浓硝酸中的HNO3见光会分解,故有时在实验室看到的浓硝酸呈黄色 |
| D.Fe在Cl2中燃烧生成FeCl3,故在与其他非金属反应的产物中Fe也显+3价 |
图所示,A池用石墨电极电解氢氧化钠溶液,B池精炼粗铜。一段时间后停止通电,A池D极产生的气体在标准状况下为2.24L,则B池中E极质量的变化是( )
| A.质量增加6.4g | B.质量增加12.8g |
| C.质量减少6.4g | D.质量减少12.8g |
下列离子反应方程式正确的是()
A.用两个铜电极电解食盐水:2Cl-+2H2O 2OH-+H2↑+Cl2↑ 2OH-+H2↑+Cl2↑ |
| B.腐蚀法制作印刷线路板:Fe3++Cu====Fe2++Cu2+ |
C.以铜作电极电解硫酸铜溶液:2Cu2++2H2O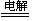 2Cu+O2↑+4H+ 2Cu+O2↑+4H+ |
D.AlCl3溶液呈酸性的原因: Al3++3H2O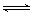 Al(OH)3+3H+ Al(OH)3+3H+ |
钢铁生锈过程发生如下反应: ①2Fe+O2+2H2O=2Fe(OH)2;
①2Fe+O2+2H2O=2Fe(OH)2; ②4Fe(OH)2+O2+2H2O=4Fe(OH)3;
②4Fe(OH)2+O2+2H2O=4Fe(OH)3; ③2Fe(OH)3=Fe2O3+3H2O。
③2Fe(OH)3=Fe2O3+3H2O。 下列说法正确的是
下列说法正确的是
A.反应①、②中电子转移数目相等 |
B.反应①中氧化剂是氧气和水 |
C.与铜质水龙头连接处的钢质水管不易发生腐蚀 |
D.钢铁在潮湿的空气中不能发生电化学腐蚀 |
用铂作电极电解下列溶液,当消耗相同电量时,在阴极上有金属析出且溶液的pH下降的是
| A.KCl | B.CuCl2 | C.CuSO4 | D.HCl |
通以相等的电量,分别电解等浓度的硝酸银和硝酸亚汞(亚汞的化合价为+1)溶液,若被还原的硝酸银和硝酸亚汞的物质的量之比n(硝酸银)∶n(硝酸亚汞)=2∶1,则下列表述正确的是()
| A.在两个阴极上得到的银和汞的物质的量之比n(硝酸银)∶n(硝酸亚汞)=2∶1 |
| B.在两个阳极上得到的产物的物质的量不相等 |
| C.硝酸亚汞的分子式为HgNO3 |
| D.硝酸亚汞的分子式为Hg2(NO3)2 |