某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化: 据此判断:
据此判断:
(1)固体B所含物质的化学式为 ;(2)固体E所含物质的化学式为 ;
(3)反应①的离子方程式为 。
工业上合成氨是在一定条件下进行如下反应:
N2(g)+3H2(g) 2NH3(g),△H=-92.2kJ/mol;其部分工艺流程如下:
2NH3(g),△H=-92.2kJ/mol;其部分工艺流程如下: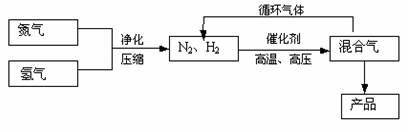
反应体系中各组分的部分性质见下表:
| 气体 |
氮气 |
氢气 |
氨 |
| 熔点(℃) |
-210.01 |
-252.77 |
-77.74 |
| 沸点(℃) |
-195.79 |
-259.23 |
-33.42 |
回答下列问题:
(1)写出该反应的化学平衡常数表达式:K=。随着温度升高,
K值(填增大、减小、不变)。
(2)平衡常数K值越大,表明(填序号)。
| A.N2的转化率越高 | B.NH3的产率越大 |
| C.原料中N2的含量越高 | D.化学反应速率越快 |
(3)合成氨反应的平衡常数很小,所以在工业上采取气体循环的流程。即反应后通过把混合气体的温度降低到使分离出来;继续循环的气体是。
氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下: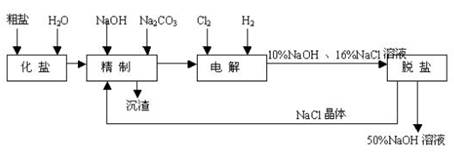
依据上图,完成下列填空:
(1)工业食盐含Ca2+、Mg2+等杂质。精制过程发生反应的离子方程式为
,
(2)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是
(选填a、b、c,多选扣分)
A. Ba(OH)2 B. Ba(NO3)2 C. BaCl2
(3)为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为
(选填a,b,c多选扣分)
a.先加NaOH,后加Na2CO3,再加钡试剂
b.先加NaOH,后加钡试剂,再加Na2CO3
c. 先加钡试剂,后加NaOH,再加Na2CO3
(4)电解过程的总反应方程为。
(5)电解槽阳极产物可用于
(至少写出两种用途)。
80℃时,将0.40mol的N2O4气体充入2 L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4  2NO2,△H>0隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2,△H>0隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间(s) n(mol) |
0 |
20 |
40 |
60 |
80 |
100 |
| n(N2O4) |
0.40 |
a |
0.20 |
c |
d |
e |
| N(NO2) |
0.00 |
0.24 |
b |
0.52 |
0.60 |
0.60 |
(1)计算20s—40s内用N2O4表示的平均反应速率为mol·L-1·s-1
(2)计算在80℃时该反应的平衡常数K=;
(3)要增大该反应的K值,可采取的措施有(填序号);
| A.增大N2O4的起始浓度 | B.向混合气体中通入NO2 |
C.使用高效催化剂 | D.升高温度 |
(4)如右图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在60℃时N2O4物质的量的变化曲线。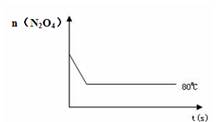
钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁
年产量的1/4。
(1)钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的电极反应式。
正极:;负极:。
(2)为了降低某水库的铁闸门被腐蚀的速率,可以采用下图所示甲的方案,其中焊接在铁闸门的固体材料R可以采用。(请写出具体金属名称)
(3)下图中乙方案也可降低铁闸门腐蚀速率,其中铁闸门应该连接在直流电源
的极。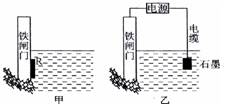
将镁、铝的混合物0.1mol 溶于100mL 2mol/LH2SO4溶液中,然后在得到的溶液中滴加1mol/LNaOH 溶液,请回答:
(1)若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+刚好完全沉淀,则加入NaOH溶液的体积是V(NaOH)=________mL。
(2)若在滴加NaOH溶液过程中,沉淀的质量随加入NaOH溶液的体积变化如下图所示。当V1=160mL时,求金属粉末中镁的物质的量和V2的体积?(要求写出解题过程)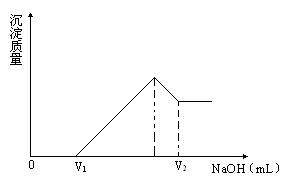
(3)若混合物仍为0.1mol ,其中Mg的物质的量分数为a,用100mL 2mol/L的H2SO4溶解此混合物后,再加入450mL 1mol/L的NaOH溶液,所得沉淀中无Al(OH)3,则满足此条件的a的取值范围为。