某学生设计了如图所示的“黑笔写红字”的趣味实验。滤纸上先用NaCl和无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹——“ ”。
”。
据此,下列叙述不正确的是( )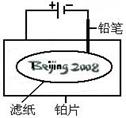
| A.铅笔作阴极:电极反应为:2H+ + 2e- = H2↑ |
| B.铂片作阳极:电极反应为:2Cl-- 2e- = Cl2↑ |
| C.铅笔与滤纸接触处有少量Cl2逸出 |
D.上述反应总的离子方程式可表示为2Cl-+2H2O 2OH-+H2↑+Cl2↑ 2OH-+H2↑+Cl2↑ |
下列关于化学反应速率的叙述,正确的是 ( )
| A.化学反应速率为0.8mol/(L·S)是指1S时该物质的浓度为0.8mol/L |
| B.化学反应速率越快,反应现象就越明显 |
| C.化学反应速率通常用单位时间内反应物浓度的减小或生成物浓度的增大来表示 |
| D.在同一反应中,用反应物或生成物物质的量浓度在单位时间内的变化表示化学反应速率值的大小相等 |
S(单斜)和S(正交)是硫的两种同素异形体。
已知:① S(单斜,s)+O2(g) ===SO2(g) △H1=-297.16 kJ·mol-1
② S(正交,s)+O2(g) ===SO2(g) △H2=-296.83 kJ·mol-1
③ S(单斜,s) ===S(正交,s) △H3
下列说法正确的是()
| A.△H3=+0.33 kJ·mol-1 |
| B.单斜硫转化为正交硫的反应是吸热反应 |
| C.S(单斜,s)===S(正交,s) △H3<0,正交硫比单斜硫稳定 |
| D.S(单斜,s)===S(正交,s) △H3<0,单斜硫比正交硫稳定 |
充分燃烧一定量的丁烷(C4H10)放出热量为Q,经测定完全吸收它生成的CO2需要消耗5mol/LKOH溶液100ml,恰好生成正盐。则燃烧1mol丁烷放出的热量为 ( )
| A.4Q | B.5Q | C.8Q | D.16Q |
下列说法中不正确的是()
| A.对于吸热反应,反应物所具有的总能量低于生成物所具有的总能量 |
| B.放热反应在常温条件下不一定能发生 |
| C.1mol硫酸跟足量氢氧化钠发生中和反应放出的热叫做中和热 |
| D.在 101 kPa 时,1 mol 纯物质完全燃烧生成最稳定的氧化物时所放出的热量就叫做该物质的燃烧热 |
关于化学反应,下列叙述中不正确的是()
①放热的反应发生时不必加热 ②化学反应一定有能量变化 ③吸热反应需要加热后才能发生 ④化学反应热效应数值(放出或吸收的热量)与参加反应的物质的多少有关
| A.① ② | B.② ③ | C.① ③ | D.② ④ |