下列有关反应的离子方程式正确的是( )
| A.碳酸氢钠溶液与少量石灰水反应:HCO3-+Ca2++OH-===CaCO3↓+H2O |
B.硫氢化钠水解:HS-+H2O H3O++S2- H3O++S2- |
| C.Ca(ClO)2溶液中通入少量的SO2:Ca2++2ClO-+SO2+H2O===2HClO+CaSO3↓ |
| D.铝片跟氢氧化钠溶液反应:2Al+2OH-+6H2O===2[Al(OH)4]-+3H2↑ |
反应A(g)+B(g)—→C(g) ΔH,分两步进行:①A(g)+B(g)—→X(g) ΔH1;②X(g)—→C(g) ΔH2。反应过程中能量变化如图所示,E1表示A+B—→X的活化能,下列说法正确的是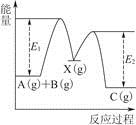
| A.ΔH1=ΔH-ΔH2>0 |
| B.X是反应A(g)+B(g)—→C(g)的催化剂 |
| C.E2是反应②的活化能 |
| D.ΔH=E1-E2 |
某研究小组在实验室用重晶石(主要成分BaSO4)对工业生产BaS进行模拟实验。BaS是可溶盐,在工业生产中,它是制备其他钡盐的中间产物。已知: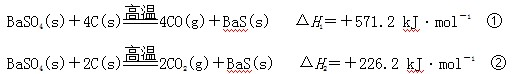
下列说法不正确的是
| A.上述反应中BaSO4均作氧化剂 |
B.反应C(g)+CO2(g) 2CO(g)的ΔH3>+172.5 kJ·mol-1 2CO(g)的ΔH3>+172.5 kJ·mol-1 |
| C.实际生产中必须加入过量的炭使BaSO4得到充分的还原,同时还要通入空气,因为①②为吸热反应,炭和氧气反应放热维持反应所需高温 |
| D.以BaS作为沉淀剂,用于铅和汞沉淀的转化 |
在25 ℃、101 kPa时,CH4(g)、H2(g)、C(s)的燃烧热分别是-890.3 kJ·mol-1、-285.8 kJ·mol-1和-393.5 kJ·mol-1,则CH4(g)—→C(s)+2H2(g)的ΔH是
| A.-74.8 kJ·mol-1 | B.+74.8 kJ·mol-1 |
| C.-211.0 kJ·mol-1 | D.+211.0 kJ·mol-1 |
已知下列反应的热化学方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l)△H1
2 H2(g)+ O2(g)= 2H2O(g)△H2
C(s)+ O2(g)=CO2(g)△H3
则反应4C3H5(ONO2)3(l)= 12CO2(g)+10H2O(g) + O2(g) +6N2(g)的△H为
| A.12△H3+5△H2-2△H1 | B.2△H1-5△H2-12△H3 |
| C.12△H3-5△H2-2△H1 | D.△H1-5△H2-12△H3 |
已知:HCN(aq)与NaOH(aq)反应的ΔH=-12.1 kJ·mol-1;HCl(aq)与NaOH(aq)反应的ΔH=-57.3 kJ·mol-1,则HCN在水溶液中电离的ΔH等于
| A.-69.4 kJ·mol-1 | B.-45.2 kJ·mol-1 |
| C.+45.2 kJ·mol-1 | D.+69.4 kJ·mol-1 |