(8分)甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应I和II来制备甲醇。
请回答下列问题:
(1)将1.0molCH4和2.0molH2O(g)通入反应室(容积为l00L),在一定条件下发生反应:
cCH4(g)+H2O(g)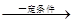 CO(g)+3H2(g) I。
CO(g)+3H2(g) I。
CH4的转化率与温度、压强的关系如图所示。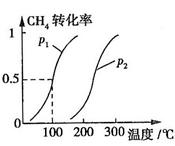
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为
②图中的P1 P2(填“<”、“>”或“=”),100℃时平衡常数为 。
③该反应的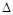 H 0。(填“<”、“>”或“=”)
H 0。(填“<”、“>”或“=”)
(2)在压强为0.1MPa条件下,a molCO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g) CH30H(g)
CH30H(g) 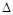 H<0 Ⅱ。
H<0 Ⅱ。
①若容器容积不变,下列措施可增加甲醇产率的是 (填序号)。
| A.升高温度 | B.将CH3OH(g)从体系中分离 |
| C.充入He,使体系总压强增大 | D.再充人lmolCO和3 mol H2 |
②为了寻找合成甲醇的适宜温度和压强,某同学设计了三组实验,部分实验条件已经填在了下面的实验设计表中。
| 实验编号 |
T(℃) |
n(CO)/n(H2) |
p(MPa) |
| l |
150 |
1/3 |
0.1 |
| 2 |
n |
1/3 |
5 |
| 3 |
350 |
m |
5 |
a.上表中剩余的实验条件数据:n= ,m= 。
b.根据反应Ⅱ的特点,如图是在压强分别为0.1MPa和5MPa下CO的转化率随温度变化的曲线图,请指明图中的压强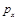 = MPa。
= MPa。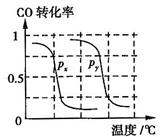
[化学——选修物质结构】
叠氮化钠(NaN3)是一种无色晶体,广泛用于汽车安全气囊及化工合成等。常见的两种制备方法为: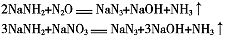
(1)①氮原子的L层电子排布图。
②氮所在的周期中,第一电离能最大的元素为(填元素符号)。
③与N3互为等电子体的粒子为____(写出一种)。
④氨气的电子式____。
(2)NH3沸点(-33.34℃)比N2O沸点(-88.49℃)高,其主要原因是
(3)依据价层电子对互斥理论,NO—3间构型呈形。
(4)汽车安全气囊的设计是基于反应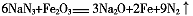 ,生成物中的铁是一种常见物质,而铁的晶体有三种堆积方式,其中两种的堆积方式如下图所示,下列有关铁及晶体的说法中正确的是。
,生成物中的铁是一种常见物质,而铁的晶体有三种堆积方式,其中两种的堆积方式如下图所示,下列有关铁及晶体的说法中正确的是。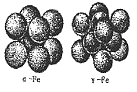
| A.金属铁的导电性是由于通电时产生的自由电子作定向移动 |
B.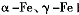 的堆积方式分别与钾和铜相同 的堆积方式分别与钾和铜相同 |
C.空间利用率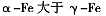 |
| D.金属铁内部存在金属键 |
(5)铁的上述两种晶体(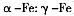 )的密度比值为。(写成小数,保留2位有效数字)
)的密度比值为。(写成小数,保留2位有效数字)
【化学——选修化学与技术】
铝生产产业链由铝土矿开采、氧化铝制取、铝的冶炼和铝材加工等环节构成。请回答下列问题:
(1)工业上采用电解氧化铝一冰晶石(Na3AlF6)熔融体的方法冶炼得到金属铝: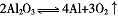 下加入冰晶石的作用:____。
下加入冰晶石的作用:____。
(2)上述工艺所得铝材中往往含有少量Fe和Si筹杂质,可用电解方法进一步提纯,该电解池中阳极的电极反应式为,下列可作阴极材料的是____
A.铝材 B.石墨 C.铅板 D.纯铝
(3)阳极氧化能使金属表面生成致密的氧化膜。以稀硫酸为电解液,铝阳极发生的电极反应式为。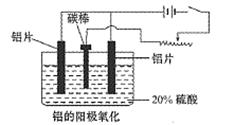
(4)在铝阳极氧化过程中,需要不断地调整电压,理由是
(5)下列说法正确的是____。
A.阳极氧化是应用原电池原理进行金属材料表面处理的技术
B.铝的阳极氧化可增强铝表面的绝缘性能
C.铝的阳极氧化可提高金属铝及其合金的耐腐蚀性,但耐磨性下降
D.铝的阳极氧化膜富有多孔性,具有很强的吸附陛能,能吸附染料而呈各种颜色
(1)不同温度下水的离子积常数如下表所示: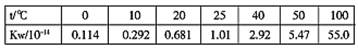
请用文字解释随温度升高水的离子积增大的原因;
10℃时纯水的电离平衡常数为;计算100℃时纯水中电离产生的氢离子浓度为。
(2)电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据:
①25℃时,有等浓度的a.NaCN溶液、b.Na2CO3溶液、c.CH3COONa溶液,三种溶液的pH由大到小的顺序为。(填写序号)
②向NaCN溶液中通入少量CO2,所发生反应的化学方程式为。
③试计算25℃时,0.1mol/L的NaCN溶液的c(OH—)为。
(3)我国从20世纪70年代开始采用硅热法炼镁,现年产量已达35.4万吨左右。根据下列条件,完成填空:
下表为长式周期表的一部分,其中的编号代表对应的元素。
(1)写出上表中元素⑩基态原子的外围电子排布图。
(2)在元素③与①形成的水果催熟剂气体化合物中,元素③的杂化方式为:。
(3)按要求完成下列各题:
a.与元素④所形成的单质互为等电子体的分子、离子的化学式、(各一种)。
b.元素④的气态氢化物X的水溶液在微电子工业中,可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为_____________________________________________________。
(4)在测定①与⑥形成化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是:。
(5)元素⑨和铁元素均可形成+2价氧化物,晶体结构类型均与氯化铯的相同,
a、比较离子半径大小:Cl—_______Cs+(填“大于”、“小于”或“等于”)。
b、元素⑨和铁的+2价离子半径分别为69 pm和78 pm,则比较两种氧化物的熔点较高的为__________(填化学式),请解释原因___________________________________________________。
(7)元素⑩所形成的单质晶体中原子的堆积方式为fcc(面心立方),晶胞边长为361pm。又知⑩单质的密度为9.00g·cm-3,原子量为63.6,请回答下列问题:
a、晶体中该原子的配位数为,一个晶胞中包含的原子数目为 。
b、⑩单质的晶胞的体积是cm3,阿伏加德罗常数为
_____________________________________(列式计算)。
有A、B、C、D、E五种短周期元素,其原子序数依次增大。A是形成化合物种类最多的元素之一,B原子核外最外层电子数是次外层电子数的2倍,C元素的基态原子2p能级上电子数是2s能级的2倍,D是该周期中原子半径最大的主族元素,E的第一至第四电离能(kJ·mol-1)分别为:578、1817、2745、11575。请回答下列问题:
(1)C、D两元素形成的化合物的晶体类型是 。BC2的电子式 。
(2)若F是D的同主族下一周期元素,则F的电子排布式是: 。
(3)写出E的最高价氧化物对应的水化物与D的最高价氧化物对应的水化物反应的离子方程式 。
(4)写出A2BC3的结构式______________________。