有A、B、C、D、E五种短周期元素,其原子序数依次增大。A是形成化合物种类最多的元素之一,B原子核外最外层电子数是次外层电子数的2倍,C元素的基态原子2p能级上电子数是2s能级的2倍,D是该周期中原子半径最大的主族元素,E的第一至第四电离能(kJ·mol-1)分别为:578、1817、2745、11575。请回答下列问题:
(1)C、D两元素形成的化合物的晶体类型是 。BC2的电子式 。
(2)若F是D的同主族下一周期元素,则F的电子排布式是: 。
(3)写出E的最高价氧化物对应的水化物与D的最高价氧化物对应的水化物反应的离子方程式 。
(4)写出A2BC3的结构式______________________。
羰基化反应是制备不饱和酯的有效途径,如:
反应①:
化合物I可由化合物Ⅲ合成:
(1)化合物Ⅱ的分子式为________,化合物Ⅱ在NaOH溶液中完全水解的化学方程式为_________。
(2)化合物Ⅲ的结构简式为________,化合物Ⅳ通过消去反应生成化合物I的化学方程式为______(注明反应条件)。
(3)化合物Ⅴ是化合物Ⅱ的同分异构体,苯环上有两个取代基且能发生银镜反应,Ⅴ的核磁共振氢谱除苯环峰外还有两组峰,峰面积之比为1︰2,Ⅴ的结构简式为_________(写一种即可)。
(4)聚合物 单体的结构简式为_________。用类似反应①的方法,利用丙炔与合适的原料可以合成该单体,化学方程式为________。
单体的结构简式为_________。用类似反应①的方法,利用丙炔与合适的原料可以合成该单体,化学方程式为________。
华法林是一种治疗心脑血管疾病的药物,可由化合物E和M在一定条件下合成得到(部分反应条件略)。
(1)A的名称为__________________,A→B的反应类型为_____________________
(2)D→E的反应中,加入的化合物X与新制Cu (OH)2反应产生砖红色沉淀的化学方程式为____________________________________________________________
(3)G→J为取代反应,其另一产物分子的结构简式为__________________
(4)L的属于酯类的同分异构体有______种;L的同分异构体Q是芳香酸,Q经下列反应
得到T。T的核磁共振氢谱只有两组峰,则Q的结构简式为,R→S的化学方程式为____________________________
(5)已知:L→M的原理为:① 和②
和② ,M的结构简式为。
,M的结构简式为。
按要求完成下列各小题。
(1)甲中显酸性的官能团是(填名称)。
(2)下列关于乙的说法正确的是(填序号)。
a.分子中碳原子与氮原子的个数比是7 : 5
b.属于芳香族化合物
c.既能与盐酸又能与氢氧化钠溶液反应
d.属于苯酚的同系物
(3)写出丙物质与足量NaOH溶液共热的化学方程式。
(4)已知以下信息:

1molB经上述反应可生成2molC,且C不能发生银镜反应。
则由A生成B的化学方程式为
(5) 的一种同分异构体满足下列条件:
的一种同分异构体满足下列条件:
Ⅰ.能发生银镜反应,其水解产物之一能与FeCl3溶液发生显色反应。
Ⅱ.分子中有6种不同化学环境的氢,且分子中含有两个苯环。
写出该同分异构体的结构简式:。
(6)已知有下列反应:
试写出只用1,3-丁二烯合成六元环化合物的结构简式。
“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题。
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式,并在方框内填上系数。
□C+□KMnO4+□H2SO4=□CO2↑+□MnSO4 +□K2SO4+□
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g) CO2(g)+H2(g),得到如下二组数据:
CO2(g)+H2(g),得到如下二组数据:
| 实验组 |
温度℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
||
| CO |
H2O |
H2 |
CO |
|||
| 1 |
650 |
4 |
2 |
1.6 |
2.4 |
6 |
| 2 |
900 |
2 |
1 |
0.4 |
1.6 |
3 |
①实验1条件下,反应从开始至达到平衡,以v(CO2)表示的反应速率为(保留小数点后二位数,下同)。
②实验2条件下平衡常数K=,该反应为 (填“吸热”或“放热”)反应。
(3)已知在常温常压下:
①2CH3OH(l) +3O2(g)=2CO2(g)+4H2O(g)ΔH1=-1275.6 kJ/mol
②2CO (g)+ O2(g)=2CO2(g)ΔH2=-566.0 kJ/mol
③H2O(g)=H2O(l)ΔH3=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式:。
(4)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置。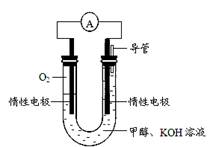
该电池正极的电极反应式为;该电池工作时,溶液中的OH-向(填“正”或“负”)极移动。
铝是一种重要的金属,在生产、生活中具有许多重要的用途,下图是从铝土矿中制备铝的工艺流程:
已知:①铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质;
②溶液中的硅酸钠与四羟基合铝酸钠反应,能生成硅铝酸盐沉淀,化学反应方程式为:
2Na2SiO3+2Na[Al(OH)4]===Na2Al2Si2O8↓+4NaOH+2H2O
回答下列问题:
(1)写出铝土矿中Al2O3与氢氧化钠溶液反应的化学方程式。
(2)过滤操作用到的玻璃仪器除了烧杯外,还有。
(3)滤渣A的主要成分为;滤渣A的用途是(写一种)。
(4)在流程第三步“酸化”中,加入的最佳物质A是___________。理由是_______ _________。
(5)将a g镁铝合金投入100mL、1mol/L的盐酸中,金属完全溶解,再加入200mL、1mol/L NaOH溶液,沉淀恰好达到最大值,质量为(a+1.7)g,镁铝合金与盐酸反应时转移的电子数为。