已知A、B、C、D分别是由短周期元素原子组成的四种微粒,它们之间有如图所示的转变关系,且A是种含有18电子的微粒,C是一种含有10电子的微粒。请完成下列各题: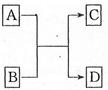
(1)若A、D分别是两种气态单质分子,写出A与B反应的化学方程
式
(2)若B、D属同主族的单质分子,写出C的化学式
(3)若B是一种含四核l8电子的分子,如果D是一种气态单质分子,B的结构简式为 ;
(4)若A、B均是含2个原子核的微粒,其中B中含有10个电子,D中含有18个电子,则A、B之间发生的离子反应方程式为
(5)若D是一种含有22电子的分子,则符合如图关系的A的物质有 (写出物质的化学式,如果是有机物则写相应的结构简式)。
某同学发现他家蔬菜地中的蔬菜生长迟缓,便施用一种氮肥,下图是氮肥包装标签的部分文字。
(1)写出工业制备该氮肥的化学方程式_______________________________________
________________________________________________________________________。
(2)说明该氮肥能否与草木灰混合使用________________________________________
________________________________________________________________________。
(3)该氮肥的纯度是________。
(1)生物有机体维持生命所必需的化学元素有40多种,其中占原生质总量95%以上的有__________________(填元素符号),这些元素被称为基本元素。这些元素组成的氧化物中,属于酸酐的是_________________________________________________________。
(2)化肥厂合成氨的化学方程式是______________________________;
反应条件是根据_____________________________________________来选择的。
阅读下面的图表和短文,简要回答问题: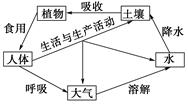
土壤污染是指土壤中积累有毒、有害物质,危害植物生长,或者残留在农作物中进入食物链而危害人体健康。人从自然界取得资源和能源,经过加工、调配和消费,最终以废弃物撒向土壤,或通过大气、水体和生物向土壤中排放和转移。当输入的污染物数量超过土壤的容量和自净能力时,必然引起土质的恶化,发生土壤污染。污染的土壤对农作物生长不利。
设计实验测定本地区土壤的酸碱性。(简要写出操作步骤)
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
据你所学化学知识提出防止土壤污染的措施。(至少3种)
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
我市某中学的同学自制一种黄色花汁,加入到不同试剂中,观察到的现象如下:
| 试剂 |
稀盐酸 |
食盐水 |
蒸馏水 |
草木灰水 |
石灰水 |
| 颜色 |
红 |
黄 |
黄 |
绿 |
绿 |
小强同学根据以上信息进行如下实验:
(1)用该花汁去检验附近小化工厂排放废水的酸碱性,显浅红色,则此废水显________性。
(2)用该花汁测知家中花盆土壤显酸性,打算加入上表中的____________________来改良。
用化学方程式表示用石膏、硫酸铝改良碱性土壤有关反应的离子(或化学)方程式____________________________、____________________________。