向100 mL 0.1mol·L—1硫酸铝铵[NH4Al(SO4)2] 溶液中逐滴滴入0.1 mol·L—1Ba(OH)2溶液。随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如右图所示。则下列说法中正确的是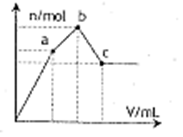
| A.a点的溶液呈酸性 |
| B.b点反应的离子方程式是:A13++2SO42—+2Ba2++3OH—=A1(OH)3↓+2BaSO4↓ |
| C.c点加入Ba (OH)2溶液的体积为200 ml. |
| D.微热,除去溶液中的氨气后,C点溶液量中性 |
下列说法中正确的是()
| A.含有金属元素的离子一定是阳离子,金属阳离子被还原一定得到金属单质 |
| B.pH相等的NaOH、NaHCO3和Na2CO3三种溶液: c(NaOH)<c(NaHCO3)<c(Na2CO3) |
| C.常温下,c(NH4+)相等的4种溶液:①(NH4)2SO4②(NH4)2Fe(SO4)2③NH4Cl ④(NH4)2CO3,溶质物质的量浓度大小关系是:②<①<④<③ |
| D.某温度时水的离子积常数KW=10-13若将此温度下pH=11的NaOH溶液aL与pH=1的稀硫酸bL混合,若所得混合液pH=2,则a:b=2:9 |
下列化学实验事实及其解释或结论都正确的是()
| A.取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ |
| B.用乙醇、冰醋酸及pH=0的H2SO4加热可制乙酸乙酯,用饱和的Na2CO3溶液可以洗去其中含有的乙醇和乙酸,说明乙酸乙酯在Na2CO3溶液中的溶解度很小 |
| C.向浓度均为0.1 mol·L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水,首先生成蓝色沉淀,说明Ksp[Cu(OH)2] >Ksp[Mg(OH)2] |
| D.配制0.10mol/L NaCl溶液,俯视容量瓶的刻度线定容,所配溶液浓度偏大 |
下列有关说法正确的是( )
| A.已知△G=△H-T△S, △G <0反应自发进行,2CO(g)+2NO(g) =N2(g)+2CO2(g)在温度为298℃时能自发进行,则它的△H>0 |
| B.0.1 mol·L-1Na2CO3溶液加蒸馏水稀释,CO32-的水解程度变大,溶液的pH不断增大 |
| C.电解精炼铜过程中,阳极质量的减少量与阴极质量的增加量一定相等 |
D.C(s)+CO2(g)  2CO(g) ⊿H>0,其他条件不变时升髙温度,CO2的反应速率和平衡转化率均增大 2CO(g) ⊿H>0,其他条件不变时升髙温度,CO2的反应速率和平衡转化率均增大 |
下列物质转化在给定的条件下能实现的是()
①
②
③石油化工采用银作催化剂,可以实现一步完成:
④
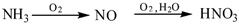 ⑤
⑤
⑥
| A.①②③④ | B.①③④⑥ | C.①③⑤⑥ | D.②④⑤⑥ |
用NA表示阿伏加德罗数,下列叙述正确的是()
| A.7.8gNa2O2固体中阴、阳离子数之和一定为0.3NA |
| B.室温下,14.0g乙烯和丁烯的混合气体中含有的氢原子数目为NA |
| C.0.1mol Fe在0.1mol Cl2中充分燃烧,转移的电子数为0.3NA |
| D.常温常压下,1mol甲基所含的电子总数为7 NA |