已知AgCl为难溶于水和酸的白色固体,Ag2S为难溶于水和酸的黑色固体。向AgCl和水形成的悬浊液中加入足量的Na2S溶液并振荡,结果白色固体完全转化为黑色固体:
(1)写出白色固体转化为黑色固体的离子方程式:________________________________________________________________________。
(2)简要说明白色固体转化为黑色固体的原因。
化合物B是以β-紫罗兰酮为起始原料制备维生素A的中间体。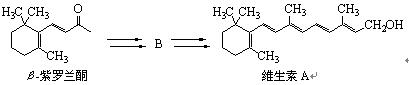
由β-紫罗兰酮生成B的过程如下所示: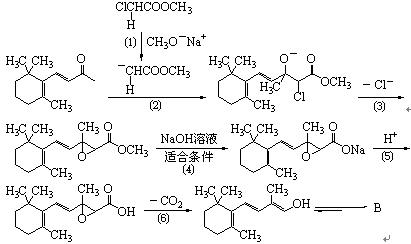
8-1 维生素A分子的不饱和度为。
8-2 芳香化合物C是β-紫罗兰酮的同分异构体,C经催化氢解生成芳香化合物D,D的1H NMR图谱中只有一个单峰。画出C的结构简式。
8-3 画出中间体B的结构简式。
8-4 以上由β-紫罗兰酮合成中间体B的过程中,⑵、⑶、⑷、⑹步反应分别属于什么反应类型(反应类型表述须具体,例如取代反应必须指明是亲电取代、亲核取代还是自由基取代)。
12000年前,地球上发生过一次大灾变,气温骤降,导致猛犸灭绝,北美Clovis文化消亡。有一种假说认为,灾变缘起一颗碳质彗星撞击地球。2010年几个研究小组发现,在北美和格林兰该地质年代的地层中存在超乎寻常浓度的纳米六方金刚石,被认为是该假设的证据。
7-1 立方金刚石的晶胞如图7-1所示。画出以两个黑色碳原子为中心的C—C键及所连接的碳原子。
7-2 图7-2上、下分别是立方金刚石和六方金刚石的碳架结构。它们的碳环构型有何不同?
7-3 六方硫化锌的晶体结构如图7-3所示。用碳原子代替硫原子和锌原子,即为六方金刚石。请在该图内用粗线框出六方金刚石的一个晶胞,要求框线必须包含图中已有的一段粗线,且框出的晶胞体积最小。
7-4 立方金刚石中周期性重复的最小单位包含个碳原子。
NO2和N2O4混合气体的针管实验是高中化学的经典素材。理论估算和实测发现,混合气体体积由V压缩为V/2,温度由298K升至311K。已知这两个温度下N2O4(g)  2NO2(g)的压力平衡常数Kp分别为0.141和0.363。
2NO2(g)的压力平衡常数Kp分别为0.141和0.363。
6-1 通过计算回答,混合气体经上述压缩后,NO2的浓度比压缩前增加了多少倍。
6-2 动力学实验证明,上述混合气体几微秒内即可达成化学平衡。压缩后的混合气体在室温下放置,颜色如何变化?为什么?
1965年合成了催化剂A,实现了温和条件下的烯烃加氢。
5-1 A是紫红色晶体,分子量925.23,抗磁性。它通过RhCl3·3H2O和过量三苯膦(PPh3)的乙醇溶液回流制得。画出A的立体结构。
5-2 A可能的催化机理如下图所示(图中16e表示中心原子周围总共有16个电子):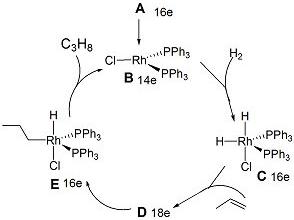
画出D的结构式。
5-3 确定图中所有配合物的中心原子的氧化态。
5-4 确定A、C、D和E的中心离子的杂化轨道类型。
5-5 用配合物的价键理论推测C和E显顺磁性还是抗磁性,说明理由。
近年来,某些轻元素的含氢化合物及其复合体系作为氢源受到广泛关注。化合物A(XYH2)和B(XH)都是具有潜在应用价值的释氢材料。A受热分解生成固体化合物C并放出刺激性气体D,D可使湿润的pH试纸变蓝。A和B混合可优化放氢性能。研究发现,该混合体系的放氢反应分三步进行:
2A =" C" + D⑴
D + B =" A" + H2⑵
C + B =" E" + H2⑶
将A和B按1∶2的摩尔(物质的量)比混合,在催化剂作用下,所含的氢全部以氢气放出,失重10.4%。
A、C、E均能水解生成F和D。G是由X和Y组成的二元化合物,其阴离子是二氧化碳的等电子体,G分解生成E和一种无色无味的气体I。写出A、B、C、D、E、F、G和I的化学式。