溴化锂常用于制冷工业,可用尿素、碳酸锂及溴为原料生产溴化锂,其原理是
3Br2+3Li2CO3+CO(NH2)2 6LiBr+2H2O+N2↑+4CO2↑其主要工艺流程如下:
6LiBr+2H2O+N2↑+4CO2↑其主要工艺流程如下:
(1)溴化时,pH过小对反应不利,一方面是因为碳酸锂会反应生成_____________,另一方面使溴单质和水的反应平衡向_______移动,温度不宜超过60℃的原因是_______。
(2)反应过程中,若pH>6,产品中会有溴酸盐,其原因是BrO-发生了自身的氧化还原反应,写出反应的离子方程式:________________。
(3)试剂X的化学式为_____________,加活性炭处理的目的是________________。
(4)若直接用氨水代替尿素也可生产溴化锂,同时生成水、二氧化碳和氮气,该反应的化学方程式为_________________。
(5)用惰性电极电解熔融碳酸锂可得到金属锂,则阳极的电极方程式为______________。
(6)若原料中碳酸锂的质量为mg,最终得到溴化锂的质量为ng,据此能不能计算出溴化锂的产率?若能请写出其表达式(含m、n的表达式);若不能,请说明理由______________。
(13分)有机物A有如下转化关系,在A的质谱图中质荷比最大值为88,其分子中C、H、O三种元素的质量比为6:1:4且A不能使Br2的CCl4溶液褪色;1molB反应生成了2molC.
请回答下列问题:
(1)C→E的反应类型为____________
(2)若①、②、③三步反应的产率分别为93.0%、81.0%、88.0%,则由A合成H的总产率为____________
(3)A的结构简式为___________________·
(4)写出C与银氨溶液反应的离子方程式为____________________________________
(5)H分子中所有碳原子均在一条直线上,G转化为H的化学方程式为__________________
(6)X是A的一种同分异构体,且其核磁共振氢谱有3个峰,峰面积之比为1:1:2,1mol X可在HIO4加热的条件下反应,产物只有1mol Y,则X的结构简式为____________
苯酚分子中与羟基相连碳原子的邻位及对位上的氢原子有很好的反应活性,
容易跟含羰基 的化合物
的化合物 (R,R′代表烷基或H原子)发生缩合反应
(R,R′代表烷基或H原子)发生缩合反应
生成新的有机物和水,苯酚还可跟酰氯 反应生成有机酸酯,例如
反应生成有机酸酯,例如
是一种优良的工程塑料,下图是由苯、丙烯、一氧化碳、氯气、氧气等合成聚碳酸酯的过程(反应条件和部分产物未写出):
请分别写出制备化合物A、B及聚碳酸酯的化学方程式(不必注反应条件,但要配平):
(1)反应①;
(2)反应②;
(3)反应③。
某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。
请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。
若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 |
K+ |
Na+ |
N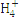 |
S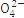 |
N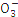 |
Cl- |
| 浓度/mol·L-1 |
4×10-6 |
6×10-6 |
2×10-5 |
4×10-5 |
3×10-5 |
2×10-5 |
根据表中数据判断PM2.5的酸碱性为 ,试样的pH= 。
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。
已知:H2(g)+ O2(g) H2O(g)ΔH="-241.8" kJ·mol-1①
O2(g) H2O(g)ΔH="-241.8" kJ·mol-1①
C(s)+ O2(g) CO(g) ΔH="-110.5" kJ·mol-1②
O2(g) CO(g) ΔH="-110.5" kJ·mol-1②
写出焦炭与水蒸气反应的热化学方程式: 。
②洗涤含SO2的烟气。以下物质可作洗涤剂的是 。
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(3)汽车尾气中NOx和CO的生成及转化
①已知汽缸中生成NO的反应为:
N2(g)+O2(g) 2NO(g) ΔH>0
2NO(g) ΔH>0
若1 mol空气含0.8 mol N2和0.2 mol O2,1 300℃时在密闭容器内反应达到平衡,测得NO为8×10-4mol。计算该温度下的平衡常数K= 。
汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是 。
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:
2CO(g) 2C(s)+O2(g)
已知该反应的ΔH>0,简述该设想能否实现的依据:
。
③目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为 。
将标准状态下体积为0.224L的某气态烃完全燃烧,保持温度为120℃,将燃烧产物依次通过浓硫酸和足量澄清石灰水,测得浓硫酸增重0.36g,生成白色沉淀质量为2g。求该气态烃的结构简式。
火力发电在我国的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题,直接排放含SO2的烟气会形成酸雨,危害环境。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:。
(2)工业上用Na2SO3溶液吸收烟气中的SO2。将烟气通入1.0 mol·L-1的Na2SO3溶液,溶液pH不断减小。当溶液pH约为6时,吸收SO2的能力显著下降,应更换吸收剂。
① 此时溶液中c(SO32–)的浓度是0.2 mol·L-1,则溶液中c(HSO3–)是_______mol•L-1。
② 向pH约为6的吸收剂中通入足量的O2,可将其中的NaHSO3转化为两种物质,反应的化学方程式是。
③ 某研究小组为探究提高含硫烟气中SO2的
吸收效率的措施,模拟实验吸收含硫烟气,实验结果如图所示。则:,
有利于提高SO2的吸收效率。
(3)工厂仓库存放的Na2SO3药品已部分被空气
氧化,该化学小组想用已知浓度的酸性KMnO4
溶液来确定其含量,具体步骤如下:
步骤i 称取样品1.000 g。
步骤ii 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤iii 移取25.00 mL样品溶液于250 mL锥形瓶中,用0.01000 mol·L-1 KMnO4标准溶液滴定至终点。
按上述操作方法再重复2次。
① 写出步骤iii所发生反应的离子方程式___________________________________;
② 在配制0.01000 mol·L-1 KMnO4溶液时若仰视定容,则最终测得药品中Na2SO3的含量________(填“偏大”、“偏小”或“无影响”)。
③ 某同学设计用下列仪器进行滴定实验(夹持部分略去),最合理的组合是_(填字母)。




A B C D E
④ 滴定结果如下表所示:
| 滴定次数 |
待测溶液 的体积/mL |
标准溶液的体积 |
|
| 滴定前刻度/mL |
滴定后刻度/mL |
||
| 1 |
25.00 |
1.02 |
21.03 |
| 2 |
25.00 |
2.00 |
21.99 |
| 3 |
25.00 |
2.20 |
20.20 |
则该药品中Na2SO3的质量分数为_________。