某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。
请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。
若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 |
K+ |
Na+ |
N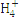 |
S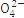 |
N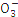 |
Cl- |
| 浓度/mol·L-1 |
4×10-6 |
6×10-6 |
2×10-5 |
4×10-5 |
3×10-5 |
2×10-5 |
根据表中数据判断PM2.5的酸碱性为 ,试样的pH= 。
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。
已知:H2(g)+ O2(g) H2O(g) ΔH="-241.8" kJ·mol-1 ①
O2(g) H2O(g) ΔH="-241.8" kJ·mol-1 ①
C(s)+ O2(g) CO(g) ΔH="-110.5" kJ·mol-1 ②
O2(g) CO(g) ΔH="-110.5" kJ·mol-1 ②
写出焦炭与水蒸气反应的热化学方程式: 。
②洗涤含SO2的烟气。以下物质可作洗涤剂的是 。
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(3)汽车尾气中NOx和CO的生成及转化
①已知汽缸中生成NO的反应为:
N2(g)+O2(g) 2NO(g) ΔH>0
2NO(g) ΔH>0
若1 mol空气含0.8 mol N2和0.2 mol O2,1 300℃时在密闭容器内反应达到平衡,测得NO为8×10-4mol。计算该温度下的平衡常数K= 。
汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是 。
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:
2CO(g) 2C(s)+O2(g)
已知该反应的ΔH>0,简述该设想能否实现的依据:
。
③目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为 。
实验室用Na2SO3固体与70%的硫酸反应制取SO2气体时,可用NaOH溶液或Fe2(SO4)3溶液吸收多余的SO2气体。
(1)用NaOH溶液吸收多余的SO2气体,若两者恰好反应生成Na2SO3溶液,则Na2SO3溶液中各微粒间浓度关系正确的是_______。
| A.c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+) |
| B.c(Na+)=2c(SO32-) + 2c(HSO3-) + 2c(H2SO3) |
| C.c(Na+) + c(H+)=2c(SO32-) + c(HSO3-) + c(OH-) |
| D.c(H+) + c(HSO3-) + 2c(H2SO3)=c(OH-) |
(2)用Fe2(SO4)3溶液吸收多余的SO2气体,写出SO2与Fe2(SO4)3溶液反应的离子方程式__________
(3)用Fe2(SO4)3溶液吸收SO2气体一段时间后,吸收液中一定存在的离子有H+、Fe2+、SO42-和极少量的OH-。某同学认为还可能存在其他离子,并提出假设进行实验探究。
①提出合理假设:
假设1:还存在HSO3-、SO32-;
假设2:还存在Fe3+;
假设3:___________________
……
②设计实验方案
| 实验步骤 |
预期现象和结论 |
| 步骤1:取少量吸收液于试管中,加稀硫酸酸化,然后再滴入几滴品红溶液; |
现象:________________________________ 结论:假设1不成立; |
| 步骤2:______________________________ ____________________________________。 |
现象:________________________________ 结论:假设2成立。 |
含碳化合物在国民经济中占有重要地位。含碳化合物的性质、制备等一直是中学化学研究的焦点。
研究情境一:工业上采用乙苯与CO2脱氢生产重要化工原料苯乙烯 △H=-166kJ·mol-1,平衡常数K
△H=-166kJ·mol-1,平衡常数K
其中乙苯在CO2气氛中的反应可分两步进行。
第一步: ΔH1,平衡常数K1
ΔH1,平衡常数K1
第二步:H2(g) +CO2(g) CO(g) + H2O(g) ΔH2=-41kJ·mol-1,平衡常数K2
CO(g) + H2O(g) ΔH2=-41kJ·mol-1,平衡常数K2
(1)上述第一步反应的ΔH1=____________,K、K1、K2之间的关系是________________。
(2)某化学研究性学习小组模拟工业用乙苯与CO2脱氢生产苯乙烯。在3L固定容积密闭容器内,乙苯与CO2的反应在I、II、III三种不同的条件下进行实验。乙苯、CO2的起始浓度分别为1.0mol·L-1和3.0mol·L-1,其中实验I在T1°C,0.3MPa,而实验II、III分别改变了实验其他条件。乙苯的浓度随时间的变化如图所示。
①实验I 苯乙烯在0—50min的平均反应速率是____________。
②实验III改变的条件可能是_______________________________________________。
③对于实验I,下列叙述能说明乙苯与CO2反应达到平衡的是_______。
a.平衡常数K不再增大b.CO2的转化率不再增大
c.混合气体的平均相对分子质量不再改变 d.反应物不再转化为生成物
研究情境二:2013年12月14日21时11分,嫦娥三号探测器在月球表面预选着陆区域成功着陆,标志我国已成为世界上第三个实现地外天体软着陆的国家。
(3)下图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH溶液为电解液。
如果某段时间内氢氧储罐中共收集到67.2L气体(标准状况),则该段时间内水电解系统中转移电子的物质的量是________mol。
(4)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2CO2=2CO + O2,同时生成的CO可用作燃料。已知该反应的阳极反应是:
4OH--4e-=O2↑+2H2O,则阴极反应是__________________。
(14分) CuCl是有机合成的重要催化剂,并用于颜料、防腐等工业。工业上由废铜料(含Fe、Al及其化合物、SiO2杂质),生产CuCl的工艺流程如下:
| 物质 |
开始沉淀 |
沉淀完全 |
| Fe(OH)3 |
2.7 |
3.7 |
| Cu(OH)2 |
5.6 |
6.7 |
| Al(OH)3 |
3.8 |
4.7 |
已知:CuCl溶于NaCl的浓溶液可生成CuCl2-,CuCl2-的溶液用水稀释后可生成CuCl沉淀。
(1)煅烧的主要目的是:。
(2)操作Ⅰ为调节溶液的PH值,范围为,加入的物质X可以是()
A、CuO B、Cu(OH)2 C、NaOH 溶液 D、CaCO3
(3)滤渣Ⅱ的主要成分是。
(4)往滤液Ⅱ中加入食盐并通入SO2可生成CuCl2-,请写出反应的离子方程式:。
(5)在反应Ⅰ中,温度控制在70~80℃并使用浓NaCl溶液,主要目的是:。
(6)常温下,已知CuOH的KSP为1.0×10-14,则Cu++H2O  CuOH + H+的平衡常数为:。
CuOH + H+的平衡常数为:。
(18分)为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物和硫氧化物含量显得尤为重要。
(1)汽车内燃机工作时会引起N2和O2的反应:N2(g)+O2(g) 2NO(g),是导致汽车尾气中含有NO的原因之一。
2NO(g),是导致汽车尾气中含有NO的原因之一。
①在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如图所示,根据图像判断反应N2(g)+O2(g) 2NO(g)的△H__________0(填“>”或“<”)。
2NO(g)的△H__________0(填“>”或“<”)。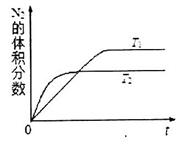
②在T3温度下,向2L密闭容器中充入10molN2与5mo1O2,50秒后达到平衡,测得NO的物质的量为2mol,则该反应的速率v (N2)=___________________。该温度下,若开始时向上述容器中充入N2与O2均为1 mol,则达到平衡后N2的转化率为____________。
(2)利用下图所示装置(电极均为惰性电极)可吸收SO2,用阴极排出的溶液可吸收NO2。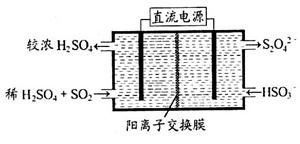
①阳极的电极反应式为_____________________。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32—生成。该反应中氧化剂与还原剂的物质的量之比为_______________。
(3)一定条件下可用甲醇与CO反应生成醋酸消除CO污染。常温下,将a mol·L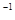 的醋酸与b mol
的醋酸与b mol L
L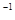 Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=______________________(用含a和b的代数式表示)。
Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=______________________(用含a和b的代数式表示)。
.(本题16分)为验证氧化性:Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和甲中加热装置已略,气密性已检验)。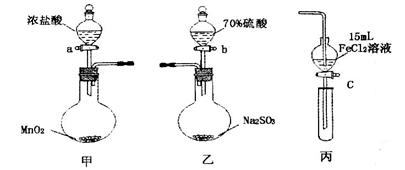
实验步骤:
1.在甲装置中,打开活塞a,加热,待装置中充满黄绿色气体时,与丙装置连接。
2.当丙装置中FeC12溶液变黄时,停止加热。
3.打开活塞c,使约2mL的溶液滴入试管中,检验溶液中的离子。
4.在乙装置中,打开活塞b,待空气排尽后,将乙中产生的气体通入上述丙装置变黄后的溶液中,一段时间后停止。
5.更新丙中试管,打开活塞c,使约2mL的溶液滴入试管中,检验溶液中的离子。
回答下列问题:
(1)甲中发生反应的化学方程式为___________________________________________。
(2)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是__________________。
(3)实验中,证明氧化性Fe3+>SO2的离子方程式为_____________________________。
(4)有I、II、III三组同学分别完成了上述实验,实验结果如下: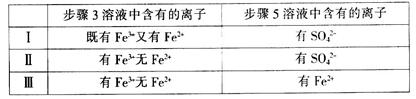
上述实验结果一定能够证明氧化性:Cl2>Fe3+>SO2的是___________(用“I”、“II”、“III”代号回答)。
(5)若要用以上甲和丙装置证明氧化性为:Cl2> Fe3+> I2的结论,则步骤为:
①往丙的漏斗中加入两种试剂_________、_________和一种溶剂__________。
②将甲装置中产生的Cl2慢慢通入丙中,观察丙的漏斗中溶液颜色变化。
③如果观察到丙中溶液_______________________________________则结论正确。
④停止通入Cl2。