(18分)为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物和硫氧化物含量显得尤为重要。
(1)汽车内燃机工作时会引起N2和O2的反应:N2(g)+O2(g) 2NO(g),是导致汽车尾气中含有NO的原因之一。
2NO(g),是导致汽车尾气中含有NO的原因之一。
①在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如图所示,根据图像判断反应N2(g)+O2(g) 2NO(g)的△H__________0(填“>”或“<”)。
2NO(g)的△H__________0(填“>”或“<”)。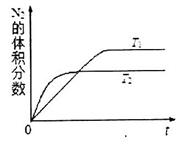
②在T3温度下,向2L密闭容器中充入10molN2与5mo1O2,50秒后达到平衡,测得NO的物质的量为2mol,则该反应的速率v (N2)=___________________。该温度下,若开始时向上述容器中充入N2与O2均为1 mol,则达到平衡后N2的转化率为____________。
(2)利用下图所示装置(电极均为惰性电极)可吸收SO2,用阴极排出的溶液可吸收NO2。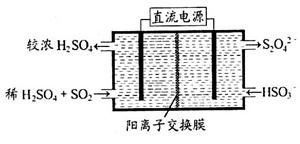
①阳极的电极反应式为_____________________。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32—生成。该反应中氧化剂与还原剂的物质的量之比为_______________。
(3)一定条件下可用甲醇与CO反应生成醋酸消除CO污染。常温下,将a mol·L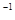 的醋酸与b mol
的醋酸与b mol L
L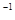 Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=______________________(用含a和b的代数式表示)。
Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=______________________(用含a和b的代数式表示)。
下列各物质哪些是电解质,哪些是非电解质?
KCl BaSO4 CH3CH2OH NaOH Fe H2SO4 H2O
某天然油脂A的分子式为C57H106O6,1 mol该油脂水解可得到1 mol甘油、1 mol不饱和脂肪酸B和2 mol 直链饱和脂肪酸C。经测定B的相对分子质量为280,原子个数比为C∶H∶O=9∶16∶1。
(1)写出B的分子式:
________________________________________________________________________。
(2)写出C的结构简式:____________;C的名称是____________。
(3)写出含5个碳原子的C的同系物的同分异构体的结构简式:________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
已知2RCH2CHO R—CH2CH===CCHOR。
R—CH2CH===CCHOR。
水杨酸酯E为紫外吸收剂,可用于配制防晒霜。E的一种合成路线如下:
请回答下列问题:
(1)一元醇A中氧的质量分数约为21.6%。则A的分子式为________,结构分析显示A只有一个甲基,A的名称为__________。
(2)B能与新制的Cu(OH)2发生反应,该反应的化学方程式为__________________________________。
(3)C有______种结构;若一次取样,检验C中所含官能团,按使用的先后顺序写出所用试剂________________________________________________________________________
________________________________________________________________________。
(4)第③的反应类型为__________;D所含官能团的名称为__________。
(5)第④步的反应条件为__________;写出E的结构简式_________________________________。
对羟基苯甲醛是一种合成医药、香料、液晶材料的重要中间体,以对甲基苯酚(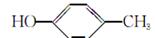 )为主要原料合成对羟基苯甲醛(
)为主要原料合成对羟基苯甲醛( )的工艺流程如图所示:
)的工艺流程如图所示:
(1)写出反应Ⅱ的化学方程式
________________________________________________________________________
________________________________________________________________________,
B能跟银氨溶液反应生成Ag,写出该反应的化学方程式
________________________________________________________________________。
(2)在生产中不直接用氧气氧化对甲基苯酚的原因是
________________________________________________________________________
________________________________________________________________________。
(3)写出对羟基苯甲醛在一定条件下与足量氢气反应的化学方程
式________________________________________________________________________
________________________________________________________________________。
(4)对羟基苯甲醛有多种同分异构体,其中苯环上只有一个侧链的同分异构体的结构简式为________________________________________________________________________。
明矾[KAl(SO4)2·12H2O] 在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含Al 、 Al2O3及少量SiO2和FeO ·xFe2O3)可制备明矾。工艺流程如下: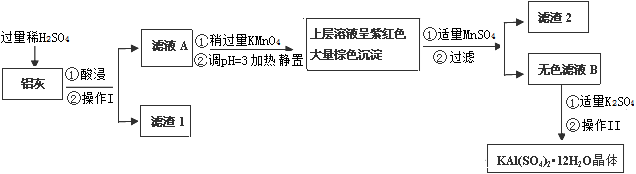
回答下列问题:
(1)明矾净水的原理是(用离子方程表示)
(2)操作Ⅰ是,操作Ⅱ是蒸发浓缩、、过滤、、干燥。
(3)检验滤液A中是否存在Fe2+的试剂是(只用一种试剂)
(4)在滤液A中加入高锰酸钾发生反应的离子方程式为(该条件下Fe2+转化为Fe3+,MnO4- 转化为Mn2+)。
已知:生成氢氧化物沉淀的pH如下表所示
| Al(OH)3 |
Fe(OH)2 |
Fe(OH)3 |
|
| 开始沉淀时 |
3.4 |
6.3 |
1.5 |
| 完全沉淀时 |
4.7 |
8.3 |
2.8 |
注:金属离子的起始浓度为0.1 mol·L-1
根据表中数据解释调pH=3的目的。
(5)己知:在pH=3、加热条件下,MnO4- 可与Mn2+反应生成MnO2。
加入MnSO4发生反应的离子方程式为:。滤渣2含有的物质
是。