【化学——选修化学与技术】
明矾石经处理后得到明矾[ KAl(SO4)2·12H2O]。从明矾制备Al、K2SO4和H2SO4的工艺过程如下所示: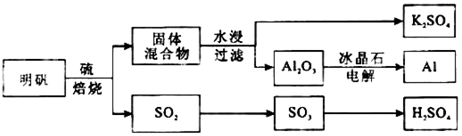
焙烧明矾的化学方程式为:4KAl(SO4)2·12H2O+3S=2K2SO4 +2Al2O3+9SO2+48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,还原剂是 ;
(2)从水浸后的滤液中得到K2SO4晶体的方法是 ;
(3)A12O3在一定条件下可制得AIN,其晶体结构如图所示,该晶体中Al的配位数是 ;
(4)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新
型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程
式是 ;
(5)焙烧产生的SO2可用于制硫酸。已知25℃、101 kPa时:
2SO2(g) +O2(g) 2SO3(g) △H1= 一197 kJ/mol;
2SO3(g) △H1= 一197 kJ/mol;
2H2O (g)=2H2O(1) △H2=一44 kJ/mol;
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l) △H3=一545 kJ/mol。
则SO3 (g)与H2O(l)反应的热化学方程式是 ;
(6)焙烧948吨明矾(M=474 g/mol ),若SO2的利用率为96%,可生产质量分数为98%的硫
酸 吨。
废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧电池的铜帽(
、
总含量约为99%)回收
并制备
的部分实验过程如下:
(1)①铜帽溶解时加入
的目的是(用化学方程式表示)。②铜帽溶解完全后, 需将溶液中过量的
除去。除去
的简便方法是。
(2)为确定加入锌灰(主要成分为
、
,杂质为铁及其氧化物)的量,实验中需测定除去
后溶液中
的含量。实验操作为:准确量取一定体积的含有
的溶液于带塞锥形瓶中,加适量水稀释,调节溶液
=3~4,加入过量的
,用
标准溶液滴定至终点。上述过程中反应的离子方程式如下:摇摇
(白色)↓
①滴定选用的指示剂为,滴定终点观察到的现象为。
②若滴定前溶液中的
没有除尽,所测定的
含量将会(填"偏高"、"偏低"或"不变")。
(3)已知
>11 时
能溶于NaOH溶液生成
。下表列出了几种离子生成氢氧化物沉淀的
(开始沉淀的
按金属离子浓度为1. 0
计算)。
| 开始沉淀的 | 沉淀完全的 | |
| 1. 1 |
3. 2 |
|
| 5. 8 |
8. 8 |
|
| 5. 9 |
8. 9 |
实验中可选用的试剂:30% 、1. 0 、1. 0 。由除去铜的滤液制备 的实验步骤依次为:①;②;③过滤;④;⑤过滤、洗涤、干燥;⑥900℃煅烧。
(12 分)硫酸钠-过氧化氢加合物( )的组成可通过下列实验测定:①准确称取1. 7700 样品,配制成100. 00 溶液A。②准确量取25. 00 溶液 ,加入盐酸酸化的 溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0. 5825 。③准确量取25. 00 溶液 ,加适量稀硫酸酸化后,用0. 02000 溶液滴定至终点,消耗 溶液25. 00 mL。 与 反应的离子方程式如下:
(1)已知室温下
的
=1.1×10-10,欲使溶液中
≤1.0×10-6
1,应保持溶液中
≤1. 0×10-6
,应保持溶液中
≥
。
(2)上述滴定若不加稀硫酸酸化,
被还原为
,其离子方程式为。
(3)通过计算确定样品的组成(写出计算过程)。
合成氨的流程示意图如下: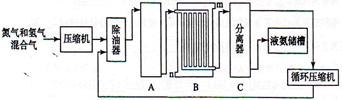
回答下列问题:
(1)工业合成氨的原料是氮气和氢气。氮气是从空气中分离出来的,通常使用的两种分离方法是,;氢气的来源是水和碳氢化合物,写出分别采用煤和天然气为原料制取氢气的化学反应方程式,;
(2)设备A中含有电加热器,触媒和热交换器,设备A的名称是,其中发生的化学反应方程式为;
(3)设备B的名称是,其中m和n是两个通水口,入水口是(填"m"或"n")。不宜从相反方向通水的原因是;
(4)设备C的作用是;
(5)在原料气制备过程中混有的CO对催化剂有毒害作用,欲除去原料气中的CO,可通过以下反应来实现:
已知1000K时该反应的平衡常数 ,若要使 的转化率超过90%,则起始物中的 不低于。
铜在我国有色金属材料的消费中仅次于铝,广泛地应用于电气、机械制造、国防等领域。回答下列问题:
(1)铜原子基态电子排布式为;
(2)用晶体的
射线衍射法可以测得阿伏加德罗常数。对金属铜的测定得到以下结果:晶胞为面心立方最密堆积,边长为361
。又知铜的密度为9.00
,则铜晶胞的体积是
、晶胞的质量是
,阿伏加德罗常数为(列式计算,己知
=63.6);
(3)氯和钾与不同价态的铜可生成两种化合物,这两种化合物都可用于催化乙炔聚合,其阴离子均为无限长链结构(如下图),
位置上
原子的杂化轨道类型为。已知其中一种化合物的化学式为
,另一种的化学式为;
(4)金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是,反应的化学方应程式为。
(9分)
实验室制备1,2-二溴乙烷的反应原理如下:
可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚。
用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如下图所示:
有关数据列表如下:
| 乙醇 |
1,2-二溴乙烷 |
乙醚 |
|
| 状态 |
色液体 |
无色液体 |
无色液体 |
| 密度/ | 0.79 |
2.2 |
0.71 |
| 沸点/℃ |
78.5 |
132 |
34.6 |
| 熔点/℃ |
一l30 |
9 |
-1l6 |
回答下列问题:
(1)在此制各实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置
中应加入,其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制各反应已经结束的最简单方法是;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在层(填"上"、"下");
(5)若产物中有少量未反应的
,最好用洗涤除去;(填正确选项前的字母)
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚.可用的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是;但又不能过度冷却(如用冰水),其原因是。