.(本题16分)为验证氧化性:Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和甲中加热装置已略,气密性已检验)。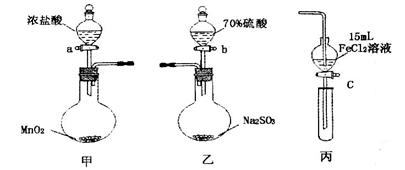
实验步骤:
1.在甲装置中,打开活塞a,加热,待装置中充满黄绿色气体时,与丙装置连接。
2.当丙装置中FeC12溶液变黄时,停止加热。
3.打开活塞c,使约2mL的溶液滴入试管中,检验溶液中的离子。
4.在乙装置中,打开活塞b,待空气排尽后,将乙中产生的气体通入上述丙装置变黄后的溶液中,一段时间后停止。
5.更新丙中试管,打开活塞c,使约2mL的溶液滴入试管中,检验溶液中的离子。
回答下列问题:
(1)甲中发生反应的化学方程式为___________________________________________。
(2)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是__________________。
(3)实验中,证明氧化性Fe3+>SO2的离子方程式为_____________________________。
(4)有I、II、III三组同学分别完成了上述实验,实验结果如下: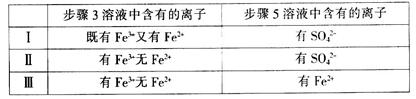
上述实验结果一定能够证明氧化性:Cl2>Fe3+>SO2的是___________(用“I”、“II”、“III”代号回答)。
(5)若要用以上甲和丙装置证明氧化性为:Cl2> Fe3+> I2的结论,则步骤为:
①往丙的漏斗中加入两种试剂_________、_________和一种溶剂__________。
②将甲装置中产生的Cl2慢慢通入丙中,观察丙的漏斗中溶液颜色变化。
③如果观察到丙中溶液_______________________________________则结论正确。
④停止通入Cl2。
合理使用材料,改善人类生活。
① 钢铁是人类生产和生活中非常重要的材料,但每年因锈蚀而损失的数量十分惊人。金属腐蚀分为化学腐蚀和电化学腐蚀,两者的微观本质都是发生的过程。为防止轮船船体在海水中被腐蚀,一般在船身连接(选填“锌块”或“铜块”)。
② 在普通玻璃制造过程中,碳酸钙与二氧化硅在高温下发生反应的化学方程式是
。橡胶是制造轮胎的重要原料,天然橡胶通过硫化措施,使它的分子转化为结构,从而增大橡胶的强度。
下图为硬脂酸甘油酯在碱性条件下水解的装置图,进行皂化反应时的步骤如下:
(1)在圆底烧瓶中装入7~8 g硬脂酸甘油酯,然后加入2~3 g的氢氧化钠、5 mL水和10 mL酒精;加入酒精的作用为_______________________________。
(2)向所得混合物中加入____________________,静置一段时间,溶液分为上下两层,肥皂在__________层。
(3)图中长玻璃管的作用是________________________________________________。
(4)写出该反应的化学方程式______________________________________________。
I、用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+ CO2(g)+2H2O(g) △H=" -574" kJ·mol-l
②CH4(g)+4NO(g)=2N2(g)+ CO2(g)+ 2H2O(g) △H=" -1160" kJ·mol-l
③H2O(g)=H2O(1) △H=-44.0 kJ·mol-l
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(1)的热化学方程式____。
II、开发新能源和三废处理都是可持续发展的重要方面。
(1)由碳的氧化物赢接合成乙醇燃料已进入大规模生产。如采取以CO和H2为原料合成乙醇,化学反应方程式:2CO(g)+4H2(g)-CH3CH2OH(g)+H2O(g);若密闭容器中充有10 mol CO与20mol H2,在催化剂作用下反应生成乙醇:CO的转化率(a)与温度、压强的关系如图所示。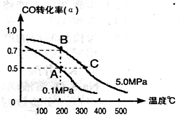
①若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为10L,则该温度下的平衡常数:K=____;
②若A、C两点都表示达到的平衡状态,则白反应开始到达平衡状态所需的时间tAtC(填 “>”、“<”或“=”)。
(2)日前工业上也可以用CO2来生产甲醇。一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H<0,若将6mo1 CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如右图所示(实线)。
CH3OH(g)+H2O(g)△H<0,若将6mo1 CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如右图所示(实线)。
①若改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变可能是,曲线II对应的实验条件改变可能是____。
②请在答题卷图中绘出甲醇的物质的量随时间变化曲线。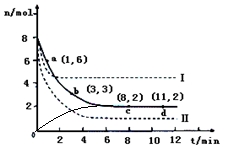
III、用MnO2制KMnO4的工艺流程如图:电解池中两极材料均为碳棒,在水或酸性溶液中K2MnO4发生歧化而变成MnO2和KMnO4。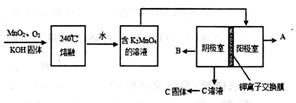
①写出240℃熔融时发生反应的化学方程式,投料时必须满足n(KOH):n(MnO2)。
②阳极的电极反应为。
③B物质是(填化学式),可以循环使用的物质是(填化学式)。
分)【化学选修
A-I为原子序数递增的前4周期的元素,已知A原子的最外层电子是次外层电子数的2倍,D为周期表中电负性最大的元素,F与C位于同一主族,E与G在周期表的位置是上下相连,两元素所在主族中所有元素都是金属,H为应用最广泛的金属;I处于周期表中的第二副族。请回答下列问题:(以下问题中的所有原子都必须在上述元素中寻找)
(1)B单质分子中 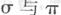 键数目比为____。B、C、D第一电离能由小到大的顺序为__________(填写元素符号)。
键数目比为____。B、C、D第一电离能由小到大的顺序为__________(填写元素符号)。
(2)H元素原子的价层电子排布式为____,H3+离
子可以与上述元素中的三种形成的某阴离子生成血红色
络合物;该阴离子又与A-I元素中的某些原子形成的分
子互为等电子体,这种分子的化学式为____(写一种即
可).该阴离子空间构型为____。
(3)D与G可以形成下图的晶胞,则黑点表示的是元素____(填写元素符号),该元素原子在该晶胞中的配位数为____.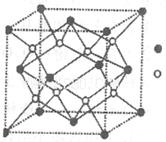
(4)若将上述晶胞圆圈对应的原子所在上下两层平面原子,按两条相互垂直的对角线上各去掉该原子2个(共去掉4个),并将小点和圆圈对应的原子更改为另外两种元素的原子,则这个晶胞化学式为____,若再将留下的所有原子换成另外一种新元素的原子,成为另外一种晶胞,该成键原子键角为;(5)已知,F单质晶体的原子堆积为ABAB型,那么,该晶体的空间利用率为____。如果F单质的摩尔质量为M,晶胞棱长为a,晶胞高度为c则,该晶体密度表达式为____。(阿伏加德罗常数用表示,不化简)如果F的原子半径为R,用R表示的晶胞高度为____。
分)【化学选修
水是一种重要的自然资源,是人类赖以生存不可缺少的物质。水质优劣直接影响人体健康。请回答下列问题:
(l)天然水中溶解的气体主要有____、____ ______(填化学式)。
(2)检验蒸馏水的纯度时,最简单易行的方法是测定水的____。
(3)水的净化与软化的区别是:水的净化是用混凝剂(如明矾等)使____,而水的软化是。
(4)通过施加一定压力使水分子透过半透膜而将大分子或离子截留,从而使水得以净化的方法称为____;电渗析法净化水时,使离子通过半透膜的推动力是____。
(5)某天然水中。c(Ca2+)=1.2×10-3mol/L,c(Mg2+)=6×10-4mol/L,c(HCO3-)=8×10-4mol/L,
要软化10 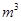 这种天然水,需先加入Ca(OH)2_______g,再加入Na2CO3_______g。
这种天然水,需先加入Ca(OH)2_______g,再加入Na2CO3_______g。