分)【化学选修
A-I为原子序数递增的前4周期的元素,已知A原子的最外层电子是次外层电子数的2倍,D为周期表中电负性最大的元素,F与C位于同一主族,E与G在周期表的位置是上下相连,两元素所在主族中所有元素都是金属,H为应用最广泛的金属;I处于周期表中的第二副族。请回答下列问题:(以下问题中的所有原子都必须在上述元素中寻找)
(1)B单质分子中 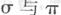 键数目比为____。B、C、D第一电离能由小到大的顺序为__________(填写元素符号)。
键数目比为____。B、C、D第一电离能由小到大的顺序为__________(填写元素符号)。
(2)H元素原子的价层电子排布式为____,H3+离
子可以与上述元素中的三种形成的某阴离子生成血红色
络合物;该阴离子又与A-I元素中的某些原子形成的分
子互为等电子体,这种分子的化学式为____(写一种即
可).该阴离子空间构型为____。
(3)D与G可以形成下图的晶胞,则黑点表示的是元素____(填写元素符号),该元素原子在该晶胞中的配位数为____.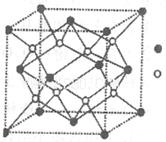
(4)若将上述晶胞圆圈对应的原子所在上下两层平面原子,按两条相互垂直的对角线上各去掉该原子2个(共去掉4个),并将小点和圆圈对应的原子更改为另外两种元素的原子,则这个晶胞化学式为____,若再将留下的所有原子换成另外一种新元素的原子,成为另外一种晶胞,该成键原子键角为 ;(5)已知,F单质晶体的原子堆积为ABAB型,那么,该晶体的空间利用率为____。如果F单质的摩尔质量为M,晶胞棱长为a,晶胞高度为c则,该晶体密度表达式为____。(阿伏加德罗常数用表示,不化简)如果F的原子半径为R,用R表示的晶胞高度为____。
I.800℃时,向容积为2L的恒容密闭容器中充入一定量的CO和H2O维持恒温,发生反应CO(g)+H2O(g) H2(g)+CO2(g),反应过���中测定的部分数据见下表:
H2(g)+CO2(g),反应过���中测定的部分数据见下表:
| 反应时间/min |
0 |
2 |
4 |
6 |
| n(CO)/mol |
1.20 |
0.90 |
0.80 |
|
| n(H2O)/ mol |
0.60 |
0.20 |
①反应在2 min内的平均速率为v(H2O)=__________;
②800℃时,化学平衡常数K的值为______________;
③保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率______(填“增大”或“减小”或“不变”)。
④在恒温恒压密闭容器中通入CO和H2O各1 mol发生该反应,当反应达到平衡后,维持温度与压强不变,t1时再通入各1 mol的CO和H2O的混合气体,请在下图中画出正(v正)、逆(v逆)反应速率在t1后随时间t变化的曲线图。
II.实验室中利用复分解反应制取Mg(OH)2。实验数据和现象如下表所示(溶液体积均取用1mL):
①现象III是;
②如果向0.028 mol/L的MgCl2溶液中加入等体积的NaOH溶液,请计算NaOH溶液的浓度至少达到mol/L时,溶液中开始出现白色沉淀(Ksp(Mg(OH)2)= 5.6×10-12)。
③MgCl2溶液和氨水混合后存在下列化学平衡:
Mg2+(aq) + 2NH3·H2O(aq) 2NH4+(aq) + Mg(OH)2(s)该反应化学平衡常数的表达式为K=,列出该反应平衡常数K与Kb(NH3·H2O)、Ksp(Mg(OH)2)的关系式。
2NH4+(aq) + Mg(OH)2(s)该反应化学平衡常数的表达式为K=,列出该反应平衡常数K与Kb(NH3·H2O)、Ksp(Mg(OH)2)的关系式。
A、B、C、D、E、F六种元素,其中A、B、C、D、E为短周期主族元素。它们之间的关系如下:
Ⅰ.原子半径:A < C< B < E< D
Ⅱ.原子的最外层电子数:A=D C=E A + B=C
Ⅲ.原子的核外电子层数:B=C=2A
Ⅳ.B元素的主要化合价:最高正价+最低负价=2
请回答:
(1)甲为由A、B两种元素组成的常见气体,写出其电子式;
(2)写出某黑色含F的磁性氧化物与E最高价氧化物对应水化物的稀溶液反应的离子方程式。装置1经过一段时间向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应为。单质F发生(填电化学腐蚀类型)
(3)向A、B、C三种元素组成的某盐稀溶液中滴加AgNO3溶液生成白色沉淀,该反应的化学方程式为,已知该盐溶液常温下呈酸性,则0.1mol/L该盐溶液中离子浓度的大小顺序为。
(4)上述元素中的五种元素可形成一种常见复盐,经检测该复盐中三种离子的个数比为2:1:2,则该复盐的化学式为。为检验该复盐中的某种有色离子存在,请写出实验的操作步骤和现象。
A、B、C、D为原子序数依次增大的四种短周期元素,其性质或结构信息如下表:
试回答以下问题
(1)B在周期表中的位置是。B的氢化物与E的氢化物比较,沸点较高的是(填化学式),在水中溶解度较大的是(填化学式)
(2)写出D3B与甲反应所得溶液呈(填“酸性”、“碱性”或“中性”),原因是(用化学方程式表示)。
(3)写出丙的电子式为。说明丙的水溶液在放置过程中其酸性会增强的原因(用离子方程式表示)。
(4)由A、B、C、D四种元素中的三种元素组成的一种盐丁,其外观与氯化钠相似,丁的水溶液呈碱性。可用来鉴别丁和氯化钠的试剂有
A.氢碘酸和淀粉的混合液 B.AgNO3溶液
C.甲基橙试剂 D.稀硫酸
(5)将光亮的铜丝插入丁溶液中,没有现象发生,如用盐酸酸化,反应迅速发生,铜丝缓慢溶解生成深绿色溶液,写出该反应的离子方程式。
A、B、C、D、E、F为原子序数依次增大的六种元素,其中A、B、C、D、E为短周期主族元素。常温下A、B、C的常见单质均为无色、无味的气体,D、E的单质均为固体。C与E同主族,且E的原子序数为C的2倍,D的最外层电子数比最内层多1个,F是人体血红蛋白中含有的一种金属元素,请回答下列问题:
(1)D元素在周期表中的位置是周期族。
(2)A与C形成的18电子分子的结构式为。
(3)最近意大利罗马大学的Funvio Cacace等人获得了极具理论研究意义的B4分子。B4分子结构如右图所示,已知断裂l molB-B吸收167kJ热量,生成1 mo1B2放出942kJ热量。根据以上信息和数据,下列说法正确的是。
A.B4比P4(白磷)既含有极性键又含有非极性键
B.l molB4气体转变为B2吸收882kJ热量
C.B4与B2互为同素异形体
D.B4与B2分子中各原子最外电子层均达到8电子稳定结构
(4)写出过量的F与稀硝酸反应的离子方程式
(5)以D为阳极,在H2SO4溶液中电解,D表面形成氧化膜,阳极电极反应式为。
(6)在常温,常压和光照条件下,B2在催化剂(TiO2)表面与A2C反应,生成1molBA3(g)和C2时的能量变化值为382.5kJ,此反应BA3生成量与温度的实验数据如下表。则该反应的热化学方程式为。
| T/K |
303 |
313 |
323 |
| BA3生成量/(10-1mol) |
4.3 |
5.9 |
6.0 |
(届上海市八校高三年级联合调研考试化学试卷)
为了预防碘缺乏症,国家规定每千克食盐中应含40~50mg碘酸钾。碘酸钾晶体有较高的稳定性,但在酸性溶液中,碘酸钾是一种较强的氧化剂,能跟某些还原剂作用生成碘;在碱性溶液中,碘酸钾能被氯气、次氯酸等强氧化剂氧化为更高价的碘的含氧酸盐。
【问题1】工业生产碘酸钾的流程如下: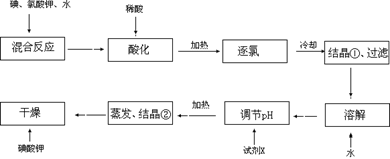
(1)碘、氯酸钾和水混合后的反应为(未配平):I2+KClO3+H2O→KH(IO3)2+KCl+Cl2↑。该方程式配平时,系数有多组,原因是。
(2)X的化学式为;写出用试剂X调节pH的化学方程式:。
(3)生产中,如果省去“酸化”、“逐氯”、“结晶①、过滤”这三步操作,直接用试剂X调整反应后溶液的pH,对生产碘酸钾有什么具体影响?。
【问题2】已知:KIO3+5KI+3H2SO4→3K2SO4+3I2+3H2O; I2+2S2O32-→2I-+S4O62-。
(4)检验加碘食盐中的碘元素,学生甲利用碘酸钾与碘化钾在酸性条件下发生反应。用四氯化碳检验碘单质时,看到的明显现象有。
(5)测定加碘食盐中碘的含量,学生乙设计的实验步骤如下:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液10.0mL恰好反应。
则加碘食盐样品中的碘元素含量是mg/kg(以含w的代数式表示)。
(6)学生丙又对纯净的NaCl(不含KIO3)进行了下列实验:
| 操作步骤 |
实验现象 |
| 取1g纯净的NaCl,加3mL水配成溶液。 |
溶液无变化 |
| 滴入5滴淀粉溶液和1mL 0.1 mol·L-1 KI溶液,振荡。 |
溶液无变化 |
| 然后再滴入1滴1mol·L-1的H2SO4,振荡。 |
溶液变蓝色 |
①推测实验中产生蓝色现象的可能原因,用离子方程式表示。
②根据学生丙的实验结果,请对学生乙的实验结果作出简要评价:。