分)【化学选修
水是一种重要的自然资源,是人类赖以生存不可缺少的物质。水质优劣直接影响人体健康。请回答下列问题:
(l)天然水中溶解的气体主要有____、____ ______(填化学式)。
(2)检验蒸馏水的纯度时,最简单易行的方法是测定水的____。
(3)水的净化与软化的区别是:水的净化是用混凝剂(如明矾等)使____,而水的软化是 。
(4)通过施加一定压力使水分子透过半透膜而将大分子或离子截留,从而使水得以净化的方法称为____;电渗析法净化水时,使离子通过半透膜的推动力是____。
(5)某天然水中。c(Ca2+)=1.2×10-3mol/L,c(Mg2+)=6×10-4mol/L,c(HCO3-)=8×10-4mol/L,
要软化10 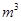 这种天然水,需先加入Ca(OH)2_______g,再加入Na2CO3_______g。
这种天然水,需先加入Ca(OH)2_______g,再加入Na2CO3_______g。
铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)要确定铁的某氯化物
的化学式,可用离子交换和滴定的方法。实验中称取0.54
的
样品,溶解后先进行阳离子交换预处理,再通过含有饱和
的阴离子交换柱,使
和
发生交换。交换完成后,流出溶液的
用0.40
的盐酸滴定,滴至终点时消耗盐酸25.0
。计算该样品中氯的物质的量,并求出
中
值:(列出计算过程);
(2)现有一含有
和
的混合物样品,采用上述方法测得
=1:2.1,则该样品中
的物质的量分数为。在实验室中,
可用铁粉和盐酸反应制备,
可用铁粉和反应制备;
(3)
与氢碘酸反应时可生成棕色物质,该反应的离子方程式为
(4)高铁酸钾( )是一种强氧化剂,可作为水处理剂和高容量电池材料。 与 在强碱性条件下反应可制取 ,其反应的离子方程式为与 电池类似, - 也可以组成碱性电池, 在电池中作为正极材料,其电极反应式为,该电池总反应的离子方程式为。
揖选做题铱本题包括
、
两小题,请选定其中一小题,并在相应的答题区域内作答。若多做,则按
小题评分。
A.一项科学研究成果表明,铜锰氧化物(
)能在常温下催化氧化空气中的一氧化碳和甲醛(
)。
(1)向一定物质的量浓度的
和
溶液中加入
溶液,所得沉淀经高温灼烧,可制得
。
①
基态的电子排布式可表示为。
②
的空间构型是(用文字描述)。
(2)在铜锰氧化物的催化下,
被氧化为
,
被氧化为
和
。
①根据等电子体原理,
分子的结构式为。
②
分子中O 原子轨道的杂化类型为。
③1
中含有的σ键数目为。
(3) 向
溶液中加入过量
溶液可生成
。不考虑空间构型,
的结构可用示意图表示为。
铝是地壳中含量最高的金属元素,其单质及合金在生产生活中的应用日趋广泛。
(1)真空碳热还原-氯化法可实现由铝土矿制备金属铝,其相关反应的热化学方程式如下:
①反应
的
=kJ·mol-1(用含
、
的代数式表示)。
②
是反应过程中的中间产物。
与盐酸反应(产物之一是含氢量最高的烃) 的化学方程式为。
(2)镁铝合金(
)是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的
、
单质在一定温度下熔炼获得。该合金在一定条件下完全吸氢的反应方程式为
。得到的混合物
(
)在一定条件下可释放出氢气。
①熔炼制备镁铝合金(
)时通入氩气的目的是。
②在
溶液中,混合物
能完全释放出
。1 mol
完全吸氢后得到的混合物
与上述盐酸完全反应,释放出
的物质的量为。
③在
和
溶液中,如图混合物
均只能部分放出氢气,反应后残留固体物质的
射线衍射谱图如图所示(
射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。在上述
溶液中,混合物
中产生氢气的主要物质是(填化学式)。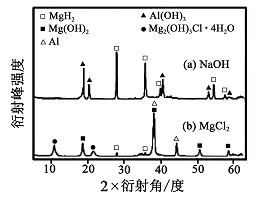
(3)铝电池性能优越,
电池可用作水下动力电源,其原理如图所示。该电池反应的化学方程式为。
废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧电池的铜帽(
、
总含量约为99%)回收
并制备
的部分实验过程如下:
(1)①铜帽溶解时加入
的目的是(用化学方程式表示)。②铜帽溶解完全后, 需将溶液中过量的
除去。除去
的简便方法是。
(2)为确定加入锌灰(主要成分为
、
,杂质为铁及其氧化物)的量,实验中需测定除去
后溶液中
的含量。实验操作为:准确量取一定体积的含有
的溶液于带塞锥形瓶中,加适量水稀释,调节溶液
=3~4,加入过量的
,用
标准溶液滴定至终点。上述过程中反应的离子方程式如下:摇摇
(白色)↓
①滴定选用的指示剂为,滴定终点观察到的现象为。
②若滴定前溶液中的
没有除尽,所测定的
含量将会(填"偏高"、"偏低"或"不变")。
(3)已知
>11 时
能溶于NaOH溶液生成
。下表列出了几种离子生成氢氧化物沉淀的
(开始沉淀的
按金属离子浓度为1. 0
计算)。
| 开始沉淀的 | 沉淀完全的 | |
| 1. 1 |
3. 2 |
|
| 5. 8 |
8. 8 |
|
| 5. 9 |
8. 9 |
实验中可选用的试剂:30% 、1. 0 、1. 0 。由除去铜的滤液制备 的实验步骤依次为:①;②;③过滤;④;⑤过滤、洗涤、干燥;⑥900℃煅烧。
(12 分)硫酸钠-过氧化氢加合物( )的组成可通过下列实验测定:①准确称取1. 7700 样品,配制成100. 00 溶液A。②准确量取25. 00 溶液 ,加入盐酸酸化的 溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0. 5825 。③准确量取25. 00 溶液 ,加适量稀硫酸酸化后,用0. 02000 溶液滴定至终点,消耗 溶液25. 00 mL。 与 反应的离子方程式如下:
(1)已知室温下
的
=1.1×10-10,欲使溶液中
≤1.0×10-6
1,应保持溶液中
≤1. 0×10-6
,应保持溶液中
≥
。
(2)上述滴定若不加稀硫酸酸化,
被还原为
,其离子方程式为。
(3)通过计算确定样品的组成(写出计算过程)。