铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)要确定铁的某氯化物的化学式,可用离子交换和滴定的方法。实验中称取0.54的样品,溶解后先进行阳离子交换预处理,再通过含有饱和的阴离子交换柱,使和发生交换。交换完成后,流出溶液的用0.40的盐酸滴定,滴至终点时消耗盐酸25.0。计算该样品中氯的物质的量,并求出中值:(列出计算过程);
(2)现有一含有和的混合物样品,采用上述方法测得=1:2.1,则该样品中的物质的量分数为。在实验室中,可用铁粉和盐酸反应制备,可用铁粉和反应制备;
(3)与氢碘酸反应时可生成棕色物质,该反应的离子方程式为
(4)高铁酸钾()是一种强氧化剂,可作为水处理剂和高容量电池材料。与在强碱性条件下反应可制取,其反应的离子方程式为与电池类似,-也可以组成碱性电池,在电池中作为正极材料,其电极反应式为,该电池总反应的离子方程式为。
工业上用乙烯和氯气为原料合成聚氯乙烯(PVC)。已知次氯酸能跟乙烯发生加成反应,以乙烯为原料制取PVC等产品的转化关系如下图所示 。
。
试回答下列问题:
(1)写出有机物B和G的结构简式:B,G;
(2)写出D的所有可能的同分异构体的结构简式;
(3)写出④反应的化学方程式;
(4)写出⑥反应的化学方程式;
反应类型是;
(14分)已知实验室由 合成
合成 的反应流程如下(部分试剂和反应条件已略去) (X代表卤素原子,R代表烃基)
的反应流程如下(部分试剂和反应条件已略去) (X代表卤素原子,R代表烃基)
请回答下列问题:
(1)分别写出B、D的结构简式:B_______________、D_______________。
(2)反应①~⑦中属于消去反应的是____ (填数字代号)。属于加成反应的是________(填数字代号)。
(3)如果不考虑⑥、⑦反应,对于反应⑤,得到的E可能的结构简式还有:。
(4)试写出C→D反应的化学方程式(有机物写结构简式,并注明反应条件)。
下表是元素周期表的一部分,针对表中的①~⑩中10种元素用元素符号或化学式填空回答以下问题:
Ⅰ.填写下列空白:
(1)非金属性最强的元素是(填元素符号),其离子结构示意图为。
(2)写出②的氢化物的电子式:,该氢化物的水溶液显______(填“酸性”、“碱性”或“中性”),该溶液与少量AlCl3溶液反应的离子方程式:。
(3)最高价氧化物对应的水化物中碱性最强的是,写出该物质与⑦的最高价氧化物对应的水化物反应的离子方程式为:。
(4)写出由③⑤⑩三种元素组成、且暴露空气中易变质的化合物化学式:;该化合物含有化学键类型有:;
写出该物质暴露空气中变质的化学方程式:。
Ⅱ.由上述部分元素组成的物质间,在一定条件下,可以发生下图中的变化,其中A是一种淡黄色固体,可作供氧剂。X是一种氢化物,常温下为液体。则: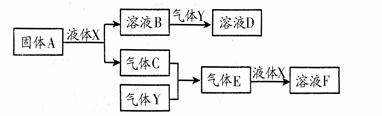
(1)写出A的晶体中存在的作用力有:;
(2)气体Y是一种大气污染物,无色、有刺激性气味的,直接排放会形成酸雨。写出气体C与气体Y反应的化学方程式:;
(3)在100 mL 18 mol/L的F浓溶液中加入过量铜片,加热使之充分反应,产生气体的体积为11.2 L(标况下),则反应过程中转移的电子数为。
X、Y、Z、M、W是原子序数依次增大的前四周期元素,X元素原子核外有三个能级,各能级电子数相等,Y的单质在空气中燃烧生成一种淡黄色的固体;Z元素原子的最外层电子数比次外层电子数少2,M原子外围电子排布式为3dn4sn;W的内层电子已全充满,最外层只有2个电子。请回答:
(1)X元素在周期表中的位置是;
W2+离子的外围电子排布式为。
(2)X 能与氢、氮、氧三种元素构成化合物 XO(NH2)2,其中X原子和N原子的杂化方式为分别为、,该化合物分子中的 键与
键与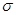 键的个数之比是;该物质易溶于水的主要原因是。
键的个数之比是;该物质易溶于水的主要原因是。
(3)已知Be和Al元素处于周期表中对角线位置,化学性质相似,请写出Y元素与Be的最高价氧化物的水化物相互反应的化学方程式
(4)M晶体的原子堆积方式为六方堆积(如图所示),则晶体中M原子配位数是。某M配合物化学式是[M(H2O)5Cl]Cl2·H2O,1 mol该配合物中含配位键的数目是。
(5)X 的某种晶体为层状结构,可与熔融金属钾作用。钾原子填充在各层之间,形成间隙化合物,其常见结构的平面投影如图①所示,则其化学式可表示为。
(6)Y离子和Z离子比较,半径较大的是___(写离子符号),元素Y与元素Z形成的晶体的晶胞结构是如图②所示的正方体,设晶胞中最近的两个Z离子的距离为a cm ,该化合物的摩尔质量为bg/ mol ,则该晶胞密度的计算式为。(只要求列算式,不必计算出数值,阿伏伽德罗常数用NA表示)。
(14分)甲醇是一种重要的化工原料,在生产中有着重要的应用。工业上用天然气为原料,分为两阶段制备甲醇:
(i)制备合成气:CH4(g)+H2O(g) CO(g)+3H2(g)△H1=+206.0kJ/mol
CO(g)+3H2(g)△H1=+206.0kJ/mol
(ii)合成甲醇:CO(g)+2H2(g) CH3OH(g)△H2
CH3OH(g)△H2
请回答下列问题:
(1)制备合成气:将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应(i);CH4的平衡转化率与温度、压强的关系如图所示。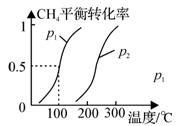
①已知100℃时达到平衡的时间为5min,则从反应开始到平衡,用氢气表示的平均反应速率为:v(H2) =。
②图中p1p2(填“<”、”“>”或“=”)。
③为解决合成气中H2过量而CO不足的问题,原料气中需添加CO2,发生反应如下:
CO2(g)+H2(g) CO(g)+H2O(g),为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为。
CO(g)+H2O(g),为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为。
(2)合成甲醇:在Cu2O/ZnO作催化剂的条件下,向2L的密闭容器中通入1mol CO(g)和2mol H2(g),发生反应(ii),反应过程中,CH3OH的物质的量(n)与时间(t)及温度的关系如图所示。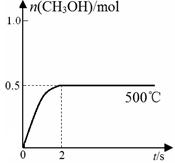
①应(ii)需在(填“高温”或“低温”)才能自发进行。
②据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量的CO2 有利于维持Cu2O的量不变,
原因是(用化学方程式表示)。
③在500℃恒压条件下,请在上图中画出反应体系中n(CH3OH)随时间t变化的总趋势图。
(3)工业上可通过甲醇羰基化法制取甲酸甲酯,其反应的热化学方程式为:
CH3OH(g)+CO(g) HCOOCH3(g)
HCOOCH3(g) 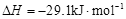 ,科研人员对该反应进行了研究,部分研究结果如下:
,科研人员对该反应进行了研究,部分研究结果如下: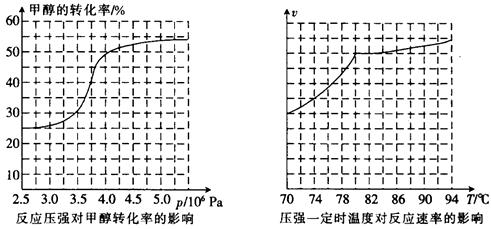
①从反应压强对甲醇转化率的影响“效率”看,工业制取甲酸甲酯应选择的压强是。 (填“3.5×106Pa”、“4.0×106Pa”或“5.0×106Pa”)。
②实际工业生产中采用的温度是80℃,其理由是。