人们每天都要摄入大量的淀粉类物质,以维持机体的营养均衡。这是因为淀粉在淀粉酶作用下或在酸性环境下可以水解成葡萄糖:
(1)已知葡萄糖化学式是C6H12O6,试推导葡萄糖分子的结构简式,已知多元醇与新制Cu(OH)2悬浊液混合可形成绛蓝色溶液。
(2)实验证明,人在长期饥饿或肝功能减退的情况下,会出现头晕、心慌、出冷汗等症状。而当一个人多食少动使得摄入的糖类过多时,又会导致肥胖。试由此推导葡萄糖在人体内的变化。
松油醇是一种调香香精,是α、β、γ三种同分异构体组成的混合物,可由松节油分馏产品A(18O是氧原子的一种同位素)经下列反应制得:
(1)α-松油醇的分子式为。
(2)写出α-松油醇中官能团的名称。
(3)α-松油醇能发生反应的类型有。
| A.加成反应 | B.消去反应 | C.氧化反应 | D.取代反应 |
(4)物质M是A的一种同分异构体,写出该物质在Cu作催化剂的条件下和氧气反应的化学方程式。
(5)写出下列物质的结构简式:β-松油醇。
环己烷可制备1,4-环己二醇,下列七步有关反应(其中无机产物都已经略去)中,其中有两步属于取代反应,两步属于消去反应,三步属于加成反应,试回答:
(1)写出下列化合物的结构简式:
A:C:
(2)写出①、④的化学方程式:
①:;
④:。
(15分)某铜矿石的成分中含有Cu2O,还含有少量的Al2O3、Fe203和Si02。某工厂利用此矿石炼制精铜的工艺流程示意图如下:
已知:CuO2+2H+=Cu+Cu2++H2O
(1)滤液A中铁元素的存在形式为(填离子符号),生成该离子的离子方程式为,检验滤液A中存在该离子的试剂为(填试剂名称)。
(2)金属E与固体F发生的某一反应可用于焊接钢轨,该反应的化学方程式为。
(3)常温下.等pH的NaAlO2和NaOH两份溶液中,由水电离出的c(OH一)前者为后者的108倍,则两种溶液的pH= 。
(4)将Na2CO3溶液滴入到一定量的CuCl2溶液中,除得到蓝色沉淀,还有无色无味气体放出,写出相应的离子方程式:。
(5)①粗铜的电解精炼如图所示。在粗铜的电解精炼过程中,c为粗铜板,则a端应连接电源的(填“正”或“负”)极,若粗铜中含有Au、Ag、Fe杂质,则电解过程中c电极上发生反应的方程式有、。
②可用酸性高锰酸钾溶液滴定法测定反应后电解液中铁元素的含量。滴定时不能用碱式滴定管盛放酸性高锰酸钾溶液的原因是、滴定中发生反应的离子方程式为,滴定时.锥形瓶中的溶液接触空气,则测得铁元素的含量会(填“偏高”或“偏低”)。
(原创)三聚氰胺(化学式:C3N6H6)是一种重要有机化工原料。下图是我国科技工作者研制的以尿素为原料生产三聚氰胺的工艺——“常压气相一步法联产纯碱新技术”:
已知:以尿素为原料生产三聚氰胺的原理是:6 CO(NH2)2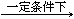 C3N6H6 +6 NH3+3CO2
C3N6H6 +6 NH3+3CO2
请回答:
(1)尿素的结构式为
(2)已知:产品1是本工艺的主产品,产品2是副产品,X为循环使用的物质,产品3为纯碱。写出各主要成份的化学式:产品1产品2X
(3)联氨系统沉淀池中发生的化学反应方程式为:
(4)为了使母液中析出更多的产品2 ,常用的方法是
| A.加入固体NaCl | B.加入固体NaHCO3 |
| C.通入CO2气体 | D.通入NH3 |
(5)若生产过程中有4%的尿素损耗,每吨尿素理论上可得副产品纯碱吨(精确到0.001)
CuSO4溶液与K2C2O4溶液混合反应,产物之一是只含一种阴离子的蓝色钾盐水合物。通过下述实验确定该晶体的组成。
步骤a:称取0.672 0 g样品,放入锥形瓶,加入适量2 mol·L-1稀硫酸,微热使样品溶解。再加入30 mL水加热,用0.200 0 mol·L-1 KMnO4溶液滴定至终点,消耗8.00 mL。
步骤b:接着将溶液充分加热,使淡紫红色消失,溶液最终呈现蓝色。冷却后,调节pH并加入过量的KI固体,溶液变为棕色并产生白色沉淀CuI。用0.250 0 mol·L-1 Na2S2O3标准溶液滴定至终点,消耗8.00 mL。
已知涉及的部分离子方程式如下:
步骤a:2 MnO4-+5C2O42-+16H+= 2Mn2++8H2O+10CO2↑
步骤b:2Cu2++4I-= 2CuI↓+I2 I2+2S2O32-= 2I-+S4O62-
(1)已知室温下CuI的Ksp=1.27×10-12,欲使溶液中c(Cu+)≤1.0×10-6 mol·L-1,应保持溶液中
c(I-)≥mol·L-1。
(2)MnO4-在酸性条件下,加热能分解为O2;同时生成Mn2+。该反应的离子方程式为;若无该操作,则测定的Cu2+的含量将会(填“偏高”、“偏低”或“不变”)。
(3)步骤b用淀粉溶液作指示剂,则滴定终点观察到的现象为。
(4)通过计算确定样品晶体的组成。