CuSO4溶液与K2C2O4溶液混合反应,产物之一是只含一种阴离子的蓝色钾盐水合物。通过下述实验确定该晶体的组成。
步骤a:称取0.672 0 g样品,放入锥形瓶,加入适量2 mol·L-1稀硫酸,微热使样品溶解。再加入30 mL水加热,用0.200 0 mol·L-1 KMnO4溶液滴定至终点,消耗8.00 mL。
步骤b:接着将溶液充分加热,使淡紫红色消失,溶液最终呈现蓝色。冷却后,调节pH并加入过量的KI固体,溶液变为棕色并产生白色沉淀CuI。用0.250 0 mol·L-1 Na2S2O3标准溶液滴定至终点,消耗8.00 mL。
已知涉及的部分离子方程式如下:
步骤a:2 MnO4-+5C2O42-+16H+= 2Mn2++8H2O+10CO2↑
步骤b:2Cu2++4I-= 2CuI↓+I2 I2+2S2O32-= 2I-+S4O62-
(1)已知室温下CuI的Ksp=1.27×10-12,欲使溶液中c(Cu+)≤1.0×10-6 mol·L-1,应保持溶液中
c(I-)≥ mol·L-1。
(2)MnO4-在酸性条件下,加热能分解为O2;同时生成Mn2+。该反应的离子方程式为 ;若无该操作,则测定的Cu2+的含量将会 (填“偏高”、“偏低”或“不变”)。
(3)步骤b用淀粉溶液作指示剂,则滴定终点观察到的现象为 。
(4)通过计算确定样品晶体的组成。
(15分)中药葛根是常用祛风解表药物,其有效成分为葛根大豆苷元,用于治疗高血压引起的头疼、头晕、突发性耳聋等症。其合成线路如下:
已知: ;
; 。
。
请回答以下问题:
(1)物质C的结构简式为
(2)对于葛根大豆苷元,下列说法正确的是
| A.1 mol葛根大豆苷元最多可以和2 molNaOH反应 | B.不发生硝化反应 |
| C.可发生水解反应 | D.与溴水可发生加成或取代反应 |
(3)步骤①变化所需加的试剂是,步骤③的反应类型为
(4)物质B发生缩聚反应生成高分子化合物的反应方程式为
(5)写出同时符合下列条件的物质C同分异构体的结构简式(写一种)
i.不能与Fe3+发生显色反应 ii.可以发生银镜反应
iii.苯环上有两种不同化学环境的氢原子
(6)有以下合成线路:
请结合所学知识和题给信息,分析上述合成线路的合理性上存在的问题
【化学——选修5:有机化学基础】(15分) 已知工业上用含氢量最高的烃A为起始原料来合成PMA等高分子。流程如下:
试回答下列问题:
(1)F中所含官能团的名称为__________。
(2)上述①②③反应中原子利用率由高到低的顺序是________________。
(3)反应③可看作________反应(填反应类型)。
(4)写出反应②的方程式_______________________。
(5)写出合成有机玻璃的反应的方程式_______________________。
【化学——选修2:化学与技术】(15分)
红矾钠(重铬酸钠:Na2Cr2O7·2H2O)是重要的基本化工原料,在印染工业、电镀工业和皮革工业中作辅助剂,在化学工业和制药工业中也可作氧化剂,应用领域十分广泛。实验室中红矾钠可用一种铬铁矿(主要成分:FeO·Cr2O3,还含有少量铝的氧化物)通过以下过程来制取。
回答下列问题:
(1)步骤Ⅰ中反应化学方程式为___FeO·Cr2O3+___Na2CO3+___O2===___Na2CrO4+___Fe2O3+___CO2。在常温下该反应速率极慢,下列措施中能使反应速率增大的是________(填字母序号)。
A.将原料粉碎 B.增加纯碱的用量 C.升高温度
(2)步骤Ⅲ需将溶液的pH调至7~8,并煮沸,其目的是________________________。
(3)步骤Ⅳ中发生反应的离子方程式为________________________________________。
(4)利用下面的复分解反应,将红矾钠与KCl固体按1∶2物质的量之比混合溶于水后经适当操作可得到K2Cr2O7晶体:Na2Cr2O7+2KCl===K2Cr2O7+2NaCl(已知:温度对氯化钠的溶解度影响很小,对重铬酸钾的溶解度影响较大)。基本实验步骤为①溶解;②________;③________;④冷却、结晶,再过滤得K2Cr2O7晶体。其中③应在_________________(填“高温”或“低温”)条件下进行。
(14分) (1)在恒温,容积为1 L恒容中,硫可以发生如下转化,其反应过程和能量关系如图1所示(已知:2SO2(g)+O2(g)  2SO3(g) ΔH=-196.6 kJ·mol-1),请回答下列问题:
2SO3(g) ΔH=-196.6 kJ·mol-1),请回答下列问题:
①写出能表示硫的燃烧热的热化学方程式:________________________________
______________________________________________________________________。
②ΔH2=__________kJ·mol-1。
③在相同条件下,充入1 mol SO3和0.5 mol的O2,则达到平衡时SO3的转化率为______________;此时该反应________(填“放出”或“吸收”)________kJ的能量。
(2)中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。
①有效“减碳”的手段之一是节能,下列制氢方法最节能的是________(填序号)。
A.电解水制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
B.高温使水分解制氢:2H2O(g) 2H2+O2
2H2+O2
C.太阳光催化分解水制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
D.天然气制氢:CH4+H2O(g) CO+3H2
CO+3H2
②CO2可转化成有机物实现碳循环。在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下反应:CO2(g)+3H2(g)  CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CO2和CH3OH(g)浓度随时间变化如图2所示。从3 min到9 min,v(H2)=________mol·L-1·min-1。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CO2和CH3OH(g)浓度随时间变化如图2所示。从3 min到9 min,v(H2)=________mol·L-1·min-1。
③能说明上述反应达到平衡状态的是________(填编号)。
A.反应中CO2与CH3OH的物质的量浓度之比为1∶1(即
图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3 mol H2,同时生成1 mol H2O
D.CO2的体积分数在混合气体中保持不变
(3)工业上,CH3OH也可由CO和H2合成。参考合成反应CO(g)+2H2(g)  CH3OH(g)的平衡常数。下列说法正确的是________。
CH3OH(g)的平衡常数。下列说法正确的是________。
| 温度/℃ |
0 |
100 |
200 |
300 |
400 |
| 平衡常数 |
667 |
13 |
1.9×10-2 |
2.4×10-4 |
1×10-5 |
A.该反应正反应是放热反应
B.该反应在低温下不能自发进行,高温下可自发进行,说明该反应ΔS<0
C.在T ℃时,1 L密闭容器中,投入0.1 mol CO和0.2 mol H2,达到平衡时,CO转化率为50%,则此时的平衡常数为100
D.工业上采用稍高的压强(5 MPa)和250 ℃,是因为此条件下,原料气转化率最高
(14分)碱式硫酸铁[Fe(OH)SO4]是一种新型高效絮凝剂,常用于污水处理,在医疗上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝等)生产碱式硫酸铁的工艺流程如下所示:
部分阳离子以氢氧化物形式沉淀时溶液的pH如表所示:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
| 开始沉淀 |
2.3 |
7.5 |
3.4 |
| 完全沉淀 |
3.2 |
9.7 |
4.4 |
请回答下列问题:
(1)加入少量NaHCO3的目的是调节溶液的pH,除去Al3+,①pH的范围__________,②写出可能发生的离子方程式:________________。
(2)在实际生产中,反应Ⅱ中常同时通入O2,以减少NaNO2的用量,O2与NaNO2在反应中均作__________。若参与反应的O2有11.2 L(标准状况),则相当于节约NaNO2的物质的量为________。
(3)碱式硫酸铁溶于水后产生的Fe(OH)2+可部分水解生成Fe2(OH)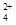 ,该水解反应的离子方程式为________________________________________________________________。
,该水解反应的离子方程式为________________________________________________________________。
Fe(OH)3的Ksp=____________。(提示,开始沉淀c(Fe3+)浓度为1.0×10-5mol/L)
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO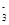 。为检验所得的产品中是否含有Fe2+,应使用的试剂为________。
。为检验所得的产品中是否含有Fe2+,应使用的试剂为________。