(14分)碱式硫酸铁[Fe(OH)SO4]是一种新型高效絮凝剂,常用于污水处理,在医疗上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝等)生产碱式硫酸铁的工艺流程如下所示:
部分阳离子以氢氧化物形式沉淀时溶液的pH如表所示:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
| 开始沉淀 |
2.3 |
7.5 |
3.4 |
| 完全沉淀 |
3.2 |
9.7 |
4.4 |
请回答下列问题:
(1)加入少量NaHCO3的目的是调节溶液的pH,除去Al3+,①pH的范围__________,②写出可能发生的离子方程式:________________。
(2)在实际生产中,反应Ⅱ中常同时通入O2,以减少NaNO2的用量,O2与NaNO2在反应中均作__________。若参与反应的O2有11.2 L(标准状况),则相当于节约NaNO2的物质的量为________。
(3)碱式硫酸铁溶于水后产生的Fe(OH)2+可部分水解生成Fe2(OH)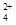 ,该水解反应的离子方程式为________________________________________________________________。
,该水解反应的离子方程式为________________________________________________________________。
Fe(OH)3的Ksp=____________。(提示,开始沉淀c(Fe3+)浓度为1.0×10-5mol/L)
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO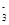 。为检验所得的产品中是否含有Fe2+,应使用的试剂为________。
。为检验所得的产品中是否含有Fe2+,应使用的试剂为________。
选考[化学——化学与技术]往有机聚合物中添加阻燃剂,可增加聚合物的使用安全性,扩大其应用范围。Mg(OH)2是一种常用的阻燃剂,生产工艺如下: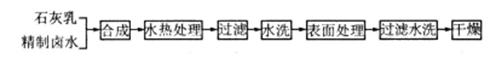
完成下列填空:
(1)精制卤水中MgCl2的与适量石灰乳反应合成碱式氯化镁 ,反应的化学方程式为_________。
,反应的化学方程式为_________。
(2)合成反应后,继续在393K~523K下水热处理8h,发生反应: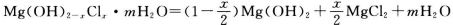 ,水热处理后,进行过滤、水洗。水洗的目的是_________。
,水热处理后,进行过滤、水洗。水洗的目的是_________。
(3)阻燃型 Mg(OH)2具有晶粒大,易分散、与高分子材料相容性好等特点。上述工艺流程中与此有关的步骤是________。
(4)已知热化学方程式: 

Mg(OH)2和Al(OH)3起阻燃作用的主要原因是_________。
等质量 Mg(OH)2和Al(OH)3相比,阻燃效果较好的是_________,原因是____________________。
(5)该工业生产的原料还可以用来提取金属镁。请设计提取金属镁的工艺流程(框内写产物名称,箭头上标明转化条件):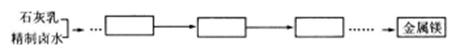
I.Li-Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为 ,则该电池的总反应式为_____________________。
,则该电池的总反应式为_____________________。
Ⅱ.锂一黄铁矿高容量电池,由于其污染小、成本低、电容量大、黄铁矿储备丰富而有望取代目前市场的碱性电池。制取高纯度黄铁矿的工艺流程如下:
(1)已知: ,为得到较纯的FeS沉淀,最好在FeCl2溶液中加入的试剂为_________(填序号)
,为得到较纯的FeS沉淀,最好在FeCl2溶液中加入的试剂为_________(填序号)
A.(NH4)2SB.CuS C.H2SD.Na2S
(2)关于白铁矿与黄铁矿下列判断错误的是_____________(填序号)
A.属于同素异形体
B.因为晶体结构不同而导致性质有差别
C.黄铁矿比白铁矿更稳定
(3)反应Ⅲ制取 S22-时,溶液必须保持为碱性,除了S2- 与酸反应外,还有更重要的原因是(用离子方程式表示)___________________________.
(4)室温下,Li/FeS2二次电池所用的电解质是非水液体电解质,放电行为与温度有关。
①该电池电解质为非水液体电解质,原因是____________________________________.
②温度低时,锂与FeS2反应只生成A物质,产生第一次放电行为;温度升高,锂与A继续反应(产物之一为Fe),产生第二次放电行为。若二次行为均进行完全且放电量恰好相等。请写出化学反应方程式:
第一次放电:__________________;第二次放电:__________________________。
(5)制取高纯度黄铁矿的另一种方法是:以LiCl- KC1低共熔点混合物为电解质,FeS为阳极,Al为阴极,在适当的电压下电解。写出阳极反应式___________________________。
研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO可用于炼铁,已知: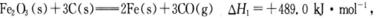
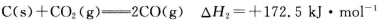
则CO还原Fe2O3(s)的热化学方程式为_________。
(2)分离高炉煤气得到的CO与空气可设计成燃料电池(以KOH溶液为电解液)。写出该电池的负极反应式:_________ 。
(3)CO2和H2充人一定体积的密闭容器中,在两种温度下发生反应: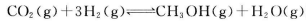 测得CH3OH的物质的量随时间的变化见图1。
测得CH3OH的物质的量随时间的变化见图1。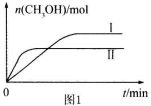
①曲线I、Ⅱ对应的平衡常数大小关系为 (填“>”或“=”或“<”)。
(填“>”或“=”或“<”)。
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。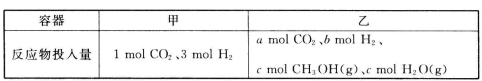
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为_________。
(4)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,在不同催化剂(工、Ⅱ,Ⅲ)作用下,CH4产量随光照时间的变化见图2。在O~15小时内,CH4的平均生成速率工、Ⅱ和Ⅲ从大到小的顺序为_________(填序号)。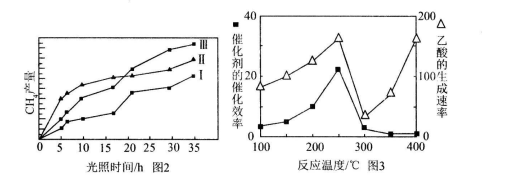
(5)以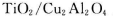 为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系见图3。
为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系见图3。
①乙酸的生成速率主要取决于温度影响的范围是__________________________________.
②Cu2Al2O4可溶于稀硝酸,写出有关的离子方程式:________________________________。
【化学选修2-化学与技术】(15分)以硼镁矿(2Mg·B2O3·H2O·SiO2 )及少量Fe3O4、CaCO3、Al2O3 )为原料生产硼酸的工艺流程如下:
(1)由于矿粉中含CaCO3,“浸取”时容易产生大量泡沫使物料从反应器中溢出,应采取的措施为_____。
(2)“浸出液”显酸性,含有H3BO3、Mg2+和SO42-,还含有Fe2+、Fe3+、Ca2+、Al3+等杂质。“除杂”时,向浸出液中依次加入适量目H2O2和MgO,可以除去的杂质离子为_________,H2O2的作用为_________(用离子方程式表示)。
(3)“浸取”后,采用“热过滤”的目的为_______。
(4)“母液”可用于回收硫酸镁,已知硫酸镁的溶解度随温度变化的曲线如图所示,且溶液的沸点随压强增大而升高。为了从“母液”中充分回收 MgSO4.H2O,应采取的措施是将“母液”蒸发浓缩,____。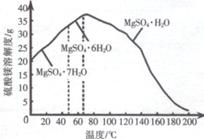
(5)已知25 ℃时,硼酸( H3BO3)溶液中存在如下平衡:
H3BO3(aq)+H2O(l) [B(OH)4]-(aq)+H+(aq) K=5.7×10-10;
[B(OH)4]-(aq)+H+(aq) K=5.7×10-10;
25 ℃时,0.7 mol·L-1硼酸溶液中c(H+)≈mol·L-1.
(6)已知25 ℃时:
| 化学式 |
H2CO3 |
CH3COOH |
| 电离常数 |
K1=4.4×10-7 K2=4.7×10-11 |
K=1.75×10-5 |
下列说法正确的是_____________(填选项字母)。
A.碳酸钠溶液滴入硼酸溶液中能观察到有气泡产生
B.碳酸钠溶液滴入醋酸溶液中能观察到有气泡产生
C.等浓度碳酸溶液和硼酸溶液的pH:前者>后者
D.等浓度碳酸钠溶液和醋酸钠溶液的pH:前者>后者
(15分)高铁酸钾(K2FeO4)是一种绿色氧化剂,在许多领域展现出广阔的应用前景。
(1)湿法制备K2FeO4:在KOH溶液中,用KC10直接氧化Fe(NO3)3即可制得K2FeO4。该反应的离子方程式为_________________________________。
(2)测定K2FeO4:样品纯度:i.称取样品mg,加入到盛有过量碱性亚铬酸钠[NaCr(OH)4]溶液的锥形瓶中充分反应;ii.将所得铬酸钠(Na2CrO4)溶液酸化;iii.在所得Na2Cr2O7溶液中加入8—9滴二苯胺磺酸钠溶液作指示剂,用c mol·L-1(NH4)2Fe(SO4)2溶液滴定至终点,消耗溶液体积为V mL。整个过程中发生的反应如下:
i.Cr(OH)4-+FeO42-+ =Fe(OH)3 (H2O)3↓+CrO42-+
=Fe(OH)3 (H2O)3↓+CrO42-+
ii.2CrO42-+2H+=Cr2O72-+H2O;
iii.Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
①配平方程式i;
②利用上述数据计算该样品的纯度为________________(用含字母的代数式表示)。
(3)高铁酸盐在水溶液中有四种含铁形体。25 ℃时,它们的物质的量分数随pH的变化如图所示: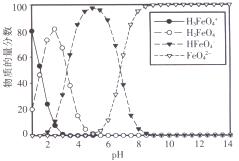
i.pH=2.2时,溶液中主要含铁形体浓度的大小关系为________;为获得尽可能纯净的高铁酸盐,pH应控制在______________。
ii.已知H3FeO4+的电离常数分别为:K1=2.51×10-2,K2=4.16×10-4,K3=5.01×10-8,当pH=4时,溶液中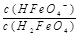 =。
=。
iii.向pH=6的高铁酸盐溶液中加入KOH溶液,发生反应的离子方程式为______________。
(4)某新型电池以金属锂为负极,K2FeO4为正极,溶有LiPF6的有机溶剂为电解质。工作时Li+通过电解质迁移人K2FeO4晶体中,生成K2Li2FeO4。该电池的正极反应式为______________.