碘是人体中不可缺少的微量元素。食盐中加入碘元素能有效防止缺碘引起的疾病。以前在食盐中加入碘化钾(KI),放置一年后,碘流失约92%。现在食盐中加入碘酸钾(KIO3),在相同条件下碘仅损失约7%
(1)食盐中加入碘化钾的碘损失率高的原因是 ;
(2)萃取碘水中的碘时,一般选用的试剂是(填字母) ;
A、酒精 B、四氯化碳 C、乙酸
(3)可用盐酸酸化的碘化钾和淀粉溶液检验食盐中的碘酸钾。反应的化学方程式为:5KI+KIO3 + 6HCl ="=" 6KCl + 3I2 + 3H2O,反应的现象是 ;
(4)已知碘酸钾受热易分解,你认为在用碘酸钾加碘盐进行烹饪时应注意什么问题? 。
高铁酸盐是一种强氧化剂,在能源、环保等方面均有广泛的用途。湿法、干法制备高铁酸钾的原理如下表所示:
| 湿法 |
强碱介质中,Fe(NO3)3与NaClO反应得到紫红色高铁酸盐溶液 |
| 干法 |
Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸钾(K2FeO4)和KNO2等产物 |
(1)某工厂用湿法制备高铁酸钾的流程如图所示: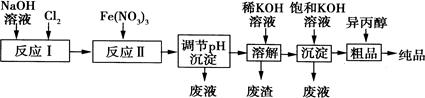
①反应I的化学方程式为。
②反应Ⅱ的离子方程式为。
③已知25℃时Fe(OH)3的Ksp=4.0×10—38,反应Ⅱ后的溶液中c(Fe3+)=4.0×10—5mol·L—1.则需调整pH=时,开始生成Fe(OH)3沉淀(不考虑溶液体积的变化)。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠溶液中加入饱和KOH溶液,即可析出高铁酸钾。
①已知高铁酸钠和水反应,有Fe(OH)3和O2生成,则高铁酸钠的氧化性比O2(填“强”或“弱”)。
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠(填“大”或“小”)。
(3)高铁酸钾是一种理想的水处理剂,其处理水的原理为。
(4)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为。
液晶高分子材料应用广泛。新型液晶基元——化合物Ⅳ的合成线路如下:
(1)化合物Ⅰ的分子式为________,1 mol化合物Ⅰ最多可与________mol NaOH反应。
(2)CH2=CH—CH2Br与NaOH水溶液反应的化学方程式为(注明条件)______________。
(3)化合物Ⅰ的同分异构体中,苯环上一溴代物只有2种且能发生银镜反应的化合物有多种,写出其中一种同分异体的结构简式____________________。
(4)下列关于化合物Ⅱ的说法正确的是_______(填字母)。
| A.属于烯烃 | B.能与FeCl3溶液反应显紫色 |
| C.一定条件下能发生加聚反应 | D.能使溴的四氯化碳溶液褪色 |
(5)反应③的反应类型是________。在一定条件下,化合物 也可与Ⅲ发生类似反应③的反应生成有机物Ⅴ。Ⅴ的结构简式是__________。
也可与Ⅲ发生类似反应③的反应生成有机物Ⅴ。Ⅴ的结构简式是__________。
硫元素有多种化合价,可形成多种化合物。
(1)常温下用1mol•L-1 100 mL NaOH溶液恰好完全吸收0.1mol SO2气体,此反应的离子方程式为;该溶液pH<7的原因是(结合方程式回答)。以石墨作电极,电解该物质的饱和溶液时,只有一个电极产生气体,写出阳极的电极反应式。
(2)请按照浓度由大到小的顺序排列0.1mol/LNa2SO3溶液中的离子。Na2SO3溶液放置于空气中一段时间后,溶液的pH(填“增大”“减小”或 “不变”)。
(3)某同学在常温下设计如下实验流程探究Na2S2O3的化学性质。
实验①可说明(填字母)
| A.该Na2S2O3溶液中水电离的c(OH—)=10—8mol/L |
| B.H2S2O3是一种弱酸 |
| C.Na2S2O3是一种弱电解质 |
D.Na2S2O3水解方程式为S2O32—+2H2O H2S2O3+2OH— H2S2O3+2OH— |
写出实验②发生反应的离子方程式。
(4)实验室制得的Na2S2O3粗晶体中往往含有少量杂质。为了测定粗产品中Na2S2O3·5H2O的含量,一般采用在酸性条件下用KMnO4标准液滴定的方法(假定粗产品中杂质与酸性KMnO4溶液不反应)。
称取1.28 g的粗样品溶于水,用0.40mol/L KMnO4溶液(加入适量硫酸酸化)滴定,当溶液中S2O32—全部被氧化时,消耗KMnO4溶液体积20.00 mL。
5S2O32—+8MnO4—+14H+ =8Mn2++10SO42—+7H2O)。试回答:
①此滴定实验是否需要指示剂(填“是”或“否”),KMnO4溶液置于(填“酸式”或“碱式”)滴定管中。
②若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3·5H2O的质量分数的测量结果(填“偏高”“偏低”或“不变”)。
③产品中Na2S2O3·5H2O的质量分数为。(Na2S2O3·5H2O式量:248)(保留小数点后两位数)
钒是一种重要的合金元素,还用于催化剂和新型电池。从含钒固体废弃物(含有SiO2、Al2O3及其他残渣)中提取钒的一种新工艺主要流程如下:
部分含钒化合物在水中的溶解性如下表:
| 物质 |
V2O5 |
NH4VO3 |
VOSO4 |
(VO2)2SO4 |
| 溶解性 |
难溶 |
难溶 |
可溶 |
易溶 |
部分含钒化合物在水中的溶解性如下表:
请回答下列问题:
(1)反应①所得溶液中除H+之外的阳离子有___________。
(2)反应②碱浸后滤出的固体主要成分是(写化学式)。
(3)反应④的离子方程式为。
(4)25℃、101 kPa时,4Al(s)+3O2(g)==2Al2O3(s)ΔH1=-a kJ/mol
4V(s)+5O2(g)==2V2O5(s) ΔH2=-b kJ/mol
用V2O5发生铝热反应冶炼金属钒的热化学方程式是。
(5)钒液流电池(如图所示)具有广阔的应用领域和市场前景,该电池中隔膜只允许H+通过。电池放电时负极的电极反应式为,电池充电时阳极的电极反应式是。
(6)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应①后溶液中的含钒量,反应的离子方程式为:2VO2++H2C2O4+2H+===2VO2++2CO2↑+2H2O。取25.00 mL 0.1000 mol/L H2C2O4标准溶液于锥形瓶中,加入指示剂,将待测液盛放在滴定管中,滴定到终点时消耗待测液24.0 mL,由此可知,该(VO2)2SO4溶液中钒的含量为g/L。
(14分)天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷。下图为以天然气为原料制备化工产品的工艺流程。
(1)CH4的VSEPR模型为
(2)一定条件下向NH4HS溶液中通入空气,得到单质硫并能使氨水再生,写出氨水再生时的化学反应方程式
(3)水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g) CH3OH(g);ΔH="-90.8" kJ·mol-1
CH3OH(g);ΔH="-90.8" kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g);ΔH=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g);ΔH=-23.5kJ·mol-1
③CO(g)+H2O(g) CO2(g) + H2(g);ΔH="-41.3" kJ·mol-1
CO2(g) + H2(g);ΔH="-41.3" kJ·mol-1
则催化反应Ⅱ室的热化学方程式为
(4)在一定条件下,反应室Ⅲ(容积为VL)中充入amolCO与2amolH2 ,在催化剂作用下反应生成甲醇:
CO(g) +2H2(g) CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,则:①P1P2(填“<”、“=”或“>”)。
CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,则:①P1P2(填“<”、“=”或“>”)。
②在其它条件不变的情况下,反应室Ⅲ再增加a mol CO与2a mol H2,达到新平衡时,CO的转化率(填“增大”、“减小”或“不变”)。
③在P1压强下,100℃时,反应:CH3OH(g) CO(g)+2H2(g)的平衡常数为(用含a、V的代数式表示)。
CO(g)+2H2(g)的平衡常数为(用含a、V的代数式表示)。
(5)科学家用氮化镓材料与铜组装如图的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4。铜电极表面的电极反应式