钒是一种重要的合金元素,还用于催化剂和新型电池。从含钒固体废弃物(含有SiO2、Al2O3及其他残渣)中提取钒的一种新工艺主要流程如下:
部分含钒化合物在水中的溶解性如下表:
| 物质 |
V2O5 |
NH4VO3 |
VOSO4 |
(VO2)2SO4 |
| 溶解性 |
难溶 |
难溶 |
可溶 |
易溶 |
部分含钒化合物在水中的溶解性如下表:
请回答下列问题:
(1)反应①所得溶液中除H+之外的阳离子有___________。
(2)反应②碱浸后滤出的固体主要成分是 (写化学式)。
(3)反应④的离子方程式为 。
(4)25℃、101 kPa时,4Al(s)+3O2(g)==2Al2O3(s) ΔH1=-a kJ/mol
4V(s)+5O2(g)==2V2O5(s) ΔH2=-b kJ/mol
用V2O5发生铝热反应冶炼金属钒的热化学方程式是 。
(5)钒液流电池(如图所示)具有广阔的应用领域和市场前景,该电池中隔膜只允许H+通过。电池放电时负极的电极反应式为 ,电池充电时阳极的电极反应式是 。
(6)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应①后溶液中的含钒量,反应的离子方程式为:2VO2++H2C2O4+2H+===2VO2++2CO2↑+2H2O。取25.00 mL 0.1000 mol/L H2C2O4标准溶液于锥形瓶中,加入指示剂,将待测液盛放在滴定管中,滴定到终点时消耗待测液24.0 mL,由此可知,该(VO2)2SO4溶液中钒的含量为 g/L。
(15分)四川省钙芒硝矿(主要成分CaSO4•Na2SO4)资源丰富。钙芒硝矿可生产具有广泛用途的芒硝(Na2SO4•10H2O)和元明粉(Na2SO4),其简要生产流程如下图所示。
请回答下列问题:
(1)浸取Na2SO4时,加入少量Na2CO3可使钙芒硝矿中的部分CaSO4转化为CaCO3,破坏钙芒硝矿结构,从而促进Na2SO4的浸取。CaSO4能转化为CaCO3的原因是_________________________。
(2)向Na2SO4的浸取液中加入适量烧碱和纯碱,Ca2+和Mg2+分别生成①________、②_________(填化学式)被过滤除去。
(3)根据下图溶解度曲线,可采用冷却结晶法从含少量NaCl的Na2SO4饱和溶液中制得芒硝的原因是___________________________________________________________________________。
(4)已知:25℃、101kPa时,
2C(s) + O2(g) ="=" 2CO(g)ΔH1 = —222kJ/mol
4Na2SO3(s) ="=" 3Na2SO4(s) + Na2S(s)ΔH2 = —122kJ/mol
2Na2SO3(s) + O2(g) ="=" 2Na2SO4(s)ΔH 3= —572kJ/mol
元明粉经碳还原制备Na2S的热化学方程式是__________________________________________________。
(5)如图,用惰性电极电解Na2SO4溶液,阳极区制得H2SO4溶液,阴极区制得NaOH溶液。其电解总反应的化学方程式是:______________________________。
(6)芒硝加热至70℃时,得到Na2SO4的饱和溶液(结晶水作溶剂,忽略加热过程中水的蒸发)和无水Na2SO4。若3220kg芒硝加热至70℃时,可析出元明粉(Na2SO4)的质量是________kg。
(本题共12分)元素周期表中ⅦA族元素的单质及其化合物的用途广泛。
23、三氟化溴(BrF3)常用于核燃料生产和后处理,遇水立即发生如下反应:3BrF3 +5H2O → HBrO3 + Br2 + 9HF+ O2 。该反应中氧化剂与还原剂的物质的量之比为,每生成2.24 LO2(标准状况)转移电子数为。
24、在食盐中添加少量碘酸钾可预防缺碘。为了检验食盐中的碘酸钾,可加入醋酸和淀粉-碘化钾溶液。看到的现象是,相应的离子方程式是。
氯常用作饮用水的杀菌剂,且HClO的杀菌能力比ClO-强。25℃时氯气-氯水体系中存在以下平衡关系:
Cl2(g)  Cl2(aq)---------------①
Cl2(aq)---------------①
Cl2(aq)+ H2O  HClO + H+ +Cl------②
HClO + H+ +Cl------②
HClO  H+ + ClO- ---------------③
H+ + ClO- ---------------③
其中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图所示。
25、写出上述体系中属于电离平衡的平衡常数表达式:Ki =,由图可知该常数值为。
26、在该体系中c(HClO) + c(ClO-) c(H+)-c(OH-)(填“大于”“小于”或“等于”)。
27、用氯处理饮用水时,夏季的杀菌效果比冬季(填“好”或“差”),请用勒夏特列原理解释。
近年来大气问题受到人们越来越多的关注。按要求回答下列问题:
Ⅰ.实现反应CH4(g)+CO2(g) 2CO(g)+2H2(g),△H0,对减少温室气体排放和减缓燃料危机具有重要意义。在2L密闭容器中,通入5mol CH4与5mol CO2的混合气体,一定条件下发生上述反应,测得CH4的平衡转化率与温度、压强的关系如图。
2CO(g)+2H2(g),△H0,对减少温室气体排放和减缓燃料危机具有重要意义。在2L密闭容器中,通入5mol CH4与5mol CO2的混合气体,一定条件下发生上述反应,测得CH4的平衡转化率与温度、压强的关系如图。
则p1、p2、p3、p4由大到小的顺序 ,该反应的正反应是______(填“吸热”或“放热”)反应,当1000℃甲烷的转化率为80%时,该反应的平衡常数K=________。
Ⅱ.PM2.5污染与直接排放化石燃烧产生的烟气有关,化石燃料燃烧同时放出大量的SO2和NOx。
(1) 处理NOx的一种方法是利用甲烷催化还原NOx。
CH4(g) + 4NO2(g) =" 4NO(g)" + CO2(g) + 2H2O(g)△H1=-574kJ·mol-1
CH4(g) + 4NO(g) = 2N2(g) + CO2(g) + 2H2O(g) △H2=-1160kJ·mol-1
CH4(g) + 2NO2 (g) = N2(g) + CO2(g) + 2H2O(g) △H3
则△H3= ,如果三个反应的平衡常数依次为K1、K2、K3,则K3=______(用K1、K2表示)
(2)实验室可用NaOH溶液吸收SO2,某小组同学在室温下,用pH传感器测定向20mL0.1mol·L-1NaOH溶液通入SO2过程中的pH变化曲线如图所示。
①ab段发生反应的离子方程式为________________。
②已知d点时溶液中溶质为NaHSO3,此时溶液中离子浓度由大到小的顺序为_______,如果NaHSO3的水解平衡常数Kh=1×10-12mol·L-1,则该温度下H2SO3的第一步电离平衡常数Ka=_________________。
我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义。
(1)原子序数为29的铜元素位于元素周期表中第周期。
(2)某青铜器中
、
的质量分别为119
、20.7
,则该青铜器中
和
原子的数目之比为。
(3)研究发现,腐蚀严重的青铜器表面大都存在
。关于
在青铜器腐蚀过程中的催化作用,下列叙述正确的是。
| A. | 降低了反应的活化能 | B. | 增大了反应的速率 |
| C. | 降低了反应的焓变 | D. | 增大了反应的平衡常数 |
(4)采用"局部封闭法"可以防止青铜器进一步被腐蚀。如将糊状
涂在被腐蚀部位,
与有害组分
发生复分解反应,该化学方程式为。
(5)下图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图。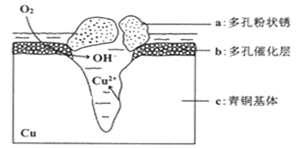
①腐蚀过程中,负极是(填图中字母"
"或"
"或"
");
②环境中的
扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈
,其离子方程式为;
③若生成4.29
,则理论上耗氧体积为
(标准状况)。
(15分)乙苯催化脱氢制苯乙烯反应: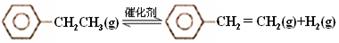
(1)已知:
| 化学键 |
C-H |
C-C |
C=C |
H-H |
| 键能/kJ·molˉ1 |
412 |
348 |
612 |
436 |
计算上述反应的△H=________ kJ·mol-1。
(2)维持体系总压强p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸汽发生催化脱氢反应。已知乙苯的平衡转化率为α,则在该温度下反应的平衡常数K=____________(用α等符号表示)。
(3)工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1︰9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如下:
①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实___________。
②控制反应温度为600℃的理由是____________。
(4)某研究机构用CO2代替水蒸气开发了绿色化学合成工艺——乙苯-二氧化碳耦合催化脱氢制苯乙烯。保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度;该工艺中还能够发生反应:CO2+H2=CO+H2O,CO2+C=2CO。新工艺的特点有_________(填编号)。
①CO2与H2反应,使乙苯脱氢反应的化学平衡右移
②不用高温水蒸气,可降低能量消耗
③有利于减少积炭
④有利于CO2资源利用