现有一包铝热剂是铝粉和氧化铁粉末的混合物,在高温下使之充分反应,将反应后的固体分为两等份,进行如下实验(假定反应前后溶液的体积不变):
①向其中一份固体中加入100 mL 2.0mol•L-1的NaOH溶液,加热使其充分反应后过滤,测得溶液C(OH—)=1mol/L
②向另一份固体中加入100mL 4.0 mol•L-1的HCl溶液,使固体全部溶解,测得反应后所得溶液中只有H+、Fe2+和Al3+三种阳离子且C(H+)=0.1mol/L则产生的气体的体积(标准状况)为
| A.2.352L | B.2.448L | C.2.688L | D.2.856L |
下列说法不正确的是()
| A.相同物质的量浓度的下列溶液中,①NH4Al(SO4)2、②NH4Cl、③CH3COONH4、④NH3·H2O; c(NH4+)由大到小的顺序是:①>②>③>④ |
| B.某物质的溶液中由水电离出的c(H+)=1×10-a mol/L,若a>7时,则该溶液的pH一定为14-a |
| C.pH=8的CH3COONa溶液中:CH3COOH浓度为9.9×10-7mol/L |
| D.pH=3的HA与pH=11的NaOH等体积混合,pH一定不会大于7 |
将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是()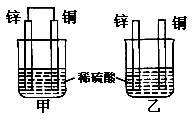
| A.两烧杯中铜片表面均有气泡产生 |
| B.甲烧杯中的电流与阳离子流向均为Zn→Cu |
| C.两烧杯中溶液的pH均增大 |
| D.两烧杯在相同时间内转移电子数相等 |
弱酸酸式盐的酸根离子电离和水解并存,已知HSO3—电离大于水解。以NaHXO3表示NaHCO3和NaHSO3。对于NaHCO3和NaHSO3溶液,下列关系式中不正确的是()
| A.c(Na+)+c(H+)=c(OH—)+c(HXO3—)+2c(XO32—) | B.c(Na+)= c(HXO3—)+ c(H2XO3)+c(XO32—) |
| C.c(Na+)> c(HXO3—)>c(H+)>c(OH—) | D.c(OH—)= c(H+)+ c(H2XO3)—c(XO32—) |
莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中。下列关于这两种有机化合物的说法正确的是()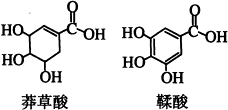
| A.鞣酸分子与莽草酸分子相比多了两个碳碳双键 |
| B.等物质的量的两种酸与足量金属钠反应产生氢气的量相同 |
| C.两种酸都能与溴水发生取代反应 |
| D.两种酸遇三氯化铁溶液都显色 |
下列离子方程式书写正确的是()
| A.NaHCO3溶液中加入过量的Ba(OH)2溶液: 2HCO3—+Ba2++2OH—====BaCO3â +2H2O+CO32— |
| B.FeCl3溶液与HI溶液反应:2Fe3++2HI=2Fe2++I2+2H+ |
| C.向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色: 2AgCl+S2—=Ag2S↓+2Cl— |
| D.石灰石与醋酸反应:CaCO3+2H+=Ca2++CO2↑+H2O |