“碳捕捉技术”是指通过一定的方法将工业生产中产生的CO2分离出来并利用。如可利用浓NaOH溶液来“捕捉”CO2,其基本过程如下图所示(部分条件及物质未标出)。下列有关该方法的叙述中不正确的是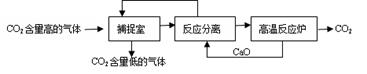
| A.能量消耗大是该方法的一大缺点 |
| B.“反应分离”环节中,分离物质的基本操作是蒸发结晶、过滤 |
| C.整个过程中,有2种物质可以循环利用 |
| D.该方法可减少碳排放,捕捉到的CO2还可用来制备甲醇等产品 |
在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入NaOH溶液体积的关系如图所示,由此确定,原溶液中含有的离子可能是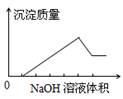
| A.Mg2+、Al3+、Fe3+ | B.H+、Mg2+、Al3+ |
| C.H+、Ba2+、Al3+ | D.Na+、Mg2+、Al3+ |
用NA表示阿伏加罗常数,下列叙述正确的是
| A.标准状况下,22.4LCCl4含有的分子数为NA |
| B.2.3gNa与足量的氧气发生反应,转移的电子数为0.2NA |
| C.通常情况下,32gO2与32gO3所含有的氧原子数均为2NA |
| D.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-数目为NA |
下列分离与提纯的方法正确的是
| A.除去Mg粉中混有的Al粉:加入足量的氨水,过滤 |
| B.除去BaCO3固体中混有的BaSO4:加入过量盐酸后,过滤、洗涤 |
| C.除去FeCl2溶液中混有的FeCl3:加入过量铁粉,过滤 |
| D.从I2的四氯化碳溶液中分离出I2:分液 |
下列关于Na2CO3与NaHCO3固体性质比较中,正确的是
| A.常温时,等浓度的溶液的碱性:Na2CO3<NaHCO3 |
| B.二者均可与澄清石灰水反应生成白色沉淀 |
| C.与同浓度的盐酸反应放出气体的速率快慢:Na2CO3>NaHCO3 |
| D.等质量的Na2CO3和NaHCO3分别与过量的盐酸反应,产物CO2的质量相等 |
下列离子方程式中,正确的是
| A.将Cl2通入H2O中:Cl2+H2O=2H++Cl-+ClO- |
| B.NaOH溶液中加入Al粉:2Al+4OH-=2AlO2-+2H2O |
| C.氯化亚铁溶液中加入新制氯水:Cl2+Fe2+═Fe3++2Cl- |
| D.NaHCO3溶液与盐酸的反应:HCO3-+H+=CO2↑+H2O |