下列表述或判断正确的是( )
| A.25℃时,pH=10的NaOH溶液与pH=10的氨水中:c(Na+)=c(NH4+) |
| B.相同条件下等物质的量浓度的①NaCl 溶液;②NaOH溶液;③HCl溶液中由水电离出的c(H+):③>①>② |
| C.在Na2CO3、NaHCO3两种溶液中,离子种类不相同 |
| D.25℃时,浓度为0.2 mol·L-1的Na2CO3溶液中只存在水解平衡,不存在电离平衡 |
如下图所示,△H1=-393.5 kJ•mol-1,△H2=-395.4 kJ•mol-1,下列说法或表示式正确的是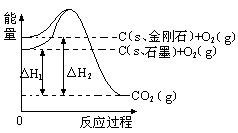
| A.石墨和金刚石的转化是物理变化 |
| B.C(s、石墨)==C(s、金刚石) △H=" +1.9" kJ•mol-1 |
| C.金刚石的稳定性强于石墨 |
| D.1 mol石墨的总键能比1 mol金刚石的总键能小1.9 kJ |
在同温同压下,下列各组热化学方程式中, △H1>△H2的是
| A.2H2(气)+O2(气)=2H2O(气) △H1 2H2(气)+O2(气)=2H2O(液) △H2 |
| B.S(气)+O2(气)=SO2(气) △H1 S(固)+O2(气)=SO2(气) △H2 |
| C.C(固)+O2 (气)=CO2(气) △H1 C(固)+1/2O2(气)=CO(气) △H2 |
| D.H2(气)+Cl2(气)=2HCl(气) △H1 1/2H2(气) +1/2Cl2(气)=HCl(气) △H2 |
在烃分子中去掉2个氢原子变成碳碳双键是吸热反应,而1,3-环己二烯失去了2个氢原子,变成苯是放热反应,根据以上信息判断下列问题正确的是
| A.1,3-环己二烯比苯稳定 |
| B.苯比1,3-环己二烯稳定 |
| C.1,3-环己二烯加氢是吸热反应 |
| D.苯加氢生成环己烷的反应中只有物质变化而无能量变化 |
已知下列两个热化学方程式
2H2(g)+O2(g)=2H2O(1) △H= -571.6KJ/mol
C3H8(g)+5O2(g)=3CO2(g)+4H2O(1) △H=-2220.0kJ/mol
实验测得,5mol氢气和丙烷的混合气体完全燃烧时放热3847kJ,则混合气体中氢气与丙烷的体积比是
| A.1:3 | B.3:1 | C.1:4 | D.1:1 |
燃烧a g乙醇(液态),生成二氧化碳气体和液态水,放出的热量为Q KJ,经测定,a g乙醇与足量钠反应,能生成标准状况下的氢气5.6L,则乙醇燃烧的热化学方程式书写正确的是
| A.C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(1) △H =" -Q" KJ/mol |
| B.C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(1) △H =" -" Q / 2 KJ/mol |
| C.1/2 C2H5OH(1)+3/2O2(g)=CO2(g)+3/2H2O(1) △H =" -Q" KJ/mol |
| D.C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(1) △H =" -2Q" KJ/mol |