(12分)
(1)已知H2A在水中存在以下电离:H2A H++HA-,HA-
H++HA-,HA- H++A2-。回答问题:
H++A2-。回答问题:
①NaHA溶液呈 (填“酸性”、“碱性”、“中性”或“无法确定”),
②某温度下,向0.1mol·L-1的NaHA溶液中滴入0.1mol·L-1KOH溶液至中性,此时溶液中以下关系一定正确的是 (填字母)。
A.c(H+)· c(OH-) =1×10-14
B.c(Na+)+c(K+)=2c(A2-)+c(HA-)
C.c(Na+)="0.05mol" ·L-1
D.c(Na+)= c(A2-)+c(HA-) +c(H2A)
(2)已知常温下:CaA(s) Ca2+(aq)+A2-(aq);△H>0,c(Ca2+)·c(A2—)为常数,记作:
Ca2+(aq)+A2-(aq);△H>0,c(Ca2+)·c(A2—)为常数,记作:
Ksp=c(Ca2+)·c(A2—)。试回答:
①温度升高时,Ksp (填“增大”、“减小”或“不变”,下同)
②滴加少量浓盐酸,c(Ca2+) ,原因是
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10—9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10—4mo1/L ,则生成沉淀所需CaCl2溶液的最小浓度为 。
1-18号元素中的某一元素,它们按图所示关系相互转化,已知A为单质。
(1)写出A→E的化学式:A、
B、C、
D、E。
(2)写出A→D反应的离子方程式
A→D。
(3)写出C→D、C→E反应的化学方程式,并标出电子转移的方向和数目。
C→D。(双线桥)
C→E。(双线桥)
实验室可以用高锰酸钾和浓盐酸反应制取氯气,反应的化学方程式如下:
2KMnO4 + 16HCl(浓)=" 2KCl" + 2MnCl2 + 5Cl2↑ + 8H2O
(1)在该反应中,氧化剂是,还原剂是。
(2)当有0.10mol电子发生转移时,生成氯气的体积为(标准状况),发生反应的KMnO4的质量为。
胃液中含有盐酸,胃酸过多的人常有胃疼的感觉,易吐酸水,服用适量的小苏打(NaHCO3),能治疗胃酸过多,反应的离子方程式是______________________;如果某病人患有胃溃疡,此时最好服用胃舒平(主要成分是氢氧化铝),反应的离子方程式是__________________.
在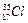 原子中含有个质子,个中子;它的原子结构示意图为。铁在氯气中燃烧,生成,在这个反应中,氯气是剂(填“氧化”,或“还原”)。
原子中含有个质子,个中子;它的原子结构示意图为。铁在氯气中燃烧,生成,在这个反应中,氯气是剂(填“氧化”,或“还原”)。
在空气中切开一块金属钠,可看到断面呈色,具有,但断面很快变,主要是由于生成一薄层,若把钠放在石棉网上加热可观察到,反应的化学方程式为,其中还原剂为。若把1.15g钠放在足量的氯气中燃烧,生成氯化钠的质量是g,反应方程式是。