学习化学应该明确“从生活中来,到生活中去”道理。在生产生活中,我们会遇到各种各样的化学物质和化学反应。
(1)工业上生产玻璃、水泥和炼铁都要用到的原料是(填名称) ,工业炼铁主要设备是
(2)请你写出工业上用氯气和消石灰反应制取漂白粉的化学反应方程式: 。
(3)请你写出胃舒平(含有氢氧化铝)治疗胃酸(盐酸)过多的离子反应方程式: 。
(4)印刷电路板是由高分子材料和铜箔复合而成,刻制印刷电路板时,要用FeCl3溶液作为“腐蚀液”。
①写出FeCl3溶液“腐蚀”铜箔的离子方程式 。
②某化学兴趣小组为分析某厂家腐蚀以后所得混合溶液组成,试探性地向100 mL腐蚀后的混合溶液中加入2.80g铁粉,结果全部溶解且未见固体析出。则混合溶液的组成为(填写化学式):
黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其煅烧产物为SO2和Fe3O4。
(1)将0.050molSO2(g)和0.030molO2(g)放入容积为1L的密闭容器中,反应:2SO2(g)+O2(g) 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol/L。计算该条件下反应的平衡常数K为 SO2的平衡转化率为 若将0.10molSO2(g)和0.060molO2(g)放入容积为1L的密闭容器中在该温度下达平衡,与前者比较,SO2的平衡转化率 SO2的体积分数 (填增大、减小、不变、无法确定)
2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol/L。计算该条件下反应的平衡常数K为 SO2的平衡转化率为 若将0.10molSO2(g)和0.060molO2(g)放入容积为1L的密闭容器中在该温度下达平衡,与前者比较,SO2的平衡转化率 SO2的体积分数 (填增大、减小、不变、无法确定)
(2)已知上述反应是放热反应,当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高SO2平衡转化率的有 (填字母)
| A.升高温度 | B.降低温度 |
| C.增大压强 | D.减小压强 |
E.加入催化剂 G.移出氧气
(3)SO2尾气用饱和Na2SO3溶液吸收可得到更重要的化工原料,反应的化学方程式为
(1)常温下,0.05mol/L硫酸溶液中,c(H+)= mol/L,pH值为 ,水电离的c(H+)= mol/L。
(2)某温度,纯水中c(H+)=3×10-7mol/L,则纯水中c(OH-)= mol/L,此时在水加入稀硫酸至c(H+)为1×10-5mol/L则此时c(OH-)= mol/L
(10分)有一包白色粉末状混合物,可能含有Na2CO3、NaCl、CaCO3、CuSO4、KCl、Na2SO4、MgCl2、KNO3中的某几种,现进行如下实验:
①将混合物溶于水,得到无色透明溶液。
②取少量上述溶液两份,其中一份加入BaCl2溶液,立即产生白色沉淀,再加上稀硝酸,沉淀不溶解,在另一份中加入NaOH溶液,也产生白色沉淀。
根据上述实验现象回答:
(1)原混合物中肯定没有__________________________。
(2)原混合物中肯定有____________________________。
(3)不能确定是否含有____________________________。
(4)写出②中所涉及到的其中一个反应的化学方程式_______________________。
请将下列实验错误操作可能会引起的不良后果填在表格中。
| 实验 |
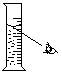
向试管中加锌粒 |
对量筒中液体读数 |
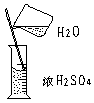
浓H2SO4 |
错误操作 |
 |
 |
 |
不良后果 |
右图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题: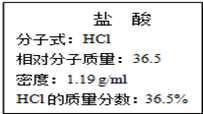
(1)该浓盐酸中HCl的物质的量浓度为______________mol•L-1。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是
| A.溶液中HCl的物质的量 | B.溶液的浓度 |
| C.溶液中Cl-的数目 | D.溶液的密度 |
(3)某学生欲用上述浓盐酸和蒸馏水配制500mL物质的量浓度为0.40mol•L-1的稀盐酸。
①该学生需要量取______________mL上述浓盐酸进行配制。
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在括号中填“偏大”、填“偏小”或“无影响”)。
Ⅰ、定容时俯视观察凹液面
Ⅱ、定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水