根据方程式:Ba(OH)2+(NH4)2SO4 BaSO4↓+2NH3↑+2H2O,请回答:
BaSO4↓+2NH3↑+2H2O,请回答:
⑴(NH4)2SO4属于 ,H2O属于 ___。(填字母)
A、电解质 B、非电解质 C、胶体
⑵写出(NH4)2SO4的电离方程式: _____ _。
⑶写出该反应的离子方程式: ___。E
(14分)X、Y、Z、L、M五种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是短周期中金属性最强的元素。回答下列问题:
(1)L的元素符号为;M在元素周期表中的位置为;L和M元素的离子半径大小顺序是(用离子符号表示)。
(2)Z、X两元素按原子数目比l∶3构成分子A,A的电子式为。
(3)硒(Se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则硒的最高价氧化物的水化物化学式为。
(4)由X、Z、L三种元素组成的离子化合物与稀NaOH溶液共热可生成使红色石蕊试纸变蓝的气体,写出该反应的离子方程式:。
(5)写出由M、L元素组成的物质的电子式。
(6分)(1)将下列物质进行分类(填序号)
① O2与O3②126C与136C③金刚石与石墨④冰与水
⑤ H2、D2、T2⑥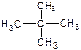 和
和
互为同位素的是互为同素异形体的是
互为同分异构体的是属于同一化合物的是
(2)写出结构式:硝基苯
联合国气候变化大会于2009年12月7-18日在哥本哈根召开。中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40 %~45 %。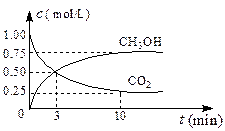
(1)有效“减碳”的手段之一是节能。下列制氢方法最节能的是。(填字母序号)
A.电解水制氢:2H2O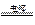 2H2↑+O2↑ 2H2↑+O2↑ |
B.高温使水分解制氢:2H2O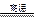 2H2↑+O2↑ 2H2↑+O2↑ |
C.太阳光催化分解水制氢:2H2O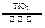 2H2↑+O2↑ 2H2↑+O2↑ |
D.天然气制氢:CH4+H2O CO+3H2 CO+3H2 |
(2)CO2可转化成有机物实现碳循环。在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
ΔH=-49.0 kJ/mol,
测得CO2和CH3OH(g)的浓度随时间变化如右图所示。
①写出由CO2和H2制取甲醇的反应的平衡常数表达式_
②从3 min到10 min,v(H2)=mol/(L·min)。
 (1)已知:
(1)已知:
O2 (g) = O+2(g) + e-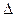 H1=" 1175.7" kJ·mol-1
H1=" 1175.7" kJ·mol-1 PtF6(g) + e- = PtF6-(g)
PtF6(g) + e- = PtF6-(g)
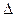 H2=" -" 771.1 kJ·mol-1
H2=" -" 771.1 kJ·mol-1 O2+ PtF6-(s) = O2+(g) + PtF6-
O2+ PtF6-(s) = O2+(g) + PtF6- 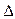 H3="482.2" kJ·mol-1
H3="482.2" kJ·mol-1 则反应O
则反应O 2(g)+ PtF6 (g) = O2+PtF6- (s)
2(g)+ PtF6 (g) = O2+PtF6- (s)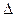 H="_____________" kJ·mol-1
H="_____________" kJ·mol-1
(2)由C和S形成的液态化合物CS2,0.2mol/l CS2在O2中完全燃烧,生成两种气态氧化物,298K时放出热量215k J。该反应的热化学方程式为________。
J。该反应的热化学方程式为________。
(3)已知:常温下0.1mol/L的某酸H2A的pH=4,则该酸为酸(填“强”或“弱”),H2A的电离方程式为,该溶液中由水电离出的c(H+)= 。
(4)一定温度下,两种酸:a、盐酸 b、醋酸:
①当两种酸的物质的量浓度相同时,c(H+):a b(填“>”、“<”或“=”,下同)。
②在pH相同、体积相同的两种酸溶液中加入过量的铁粉,反应结束时生成H2的总体积:a b。
③将pH相同,体积相同的两种酸溶液分别加水稀释100倍,所得溶液的pH值:a b
现有K O S H四种元素,请选用其中一种或几种元素组成符合下列要求的物质,完成下列转化:
(1)单质 → 化合物:;
(2)酸 →盐:;
(3)酸性氧化物 → 盐:;
(4)碱性氧化物 → 碱:。