X、Y、Z、W四种短周期元素在周期表中的位置关系如图: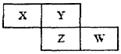
若Z元素原子的最外层电子数是电子层数的2倍
(1)W在周期表中的位置为 。
(2)Y和Z元素形成的氢化物的沸点高低比较为 ,原因是 。
(3)含X元素的四核10电子微粒的电子式为 。
(4)写出铜和X的最高价氧化物水化物的稀溶液反应的离子方程式为 。
(5)W最高价氧化物水化物的浓溶液不稳定,受热可分解,产物之一是黄绿色气体,且当有28 mol电子转移时,共产生9 mol气体,写出该反应的化学方程式 。
肼(N2H4)可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)===N2O4(l)ΔH1=-19.5 kJ·mol-1
②N2H4(l)+O2(g)===N2(g)+2H2O(g)ΔH2=-534.2 kJ·mol-1
(1)写出肼和N2O4反应的热化学方程式__________。
(2)已知H2O(l)===H2O(g)ΔH3=+44 kJ·mol-1,则表示肼燃烧热的热化学方程式为__________。
(3)肼—空气燃料电池是一种碱性电池,该电池放电时,负极的反应式为__________。
(1)在一个固定体积为2升的密闭容器中,充入2molA和1molB,发生如下反应:2A(g)+B(g) 3C(g)+D(s),2分钟反应达到平衡,此时C的浓度为1.2 mol/L。
3C(g)+D(s),2分钟反应达到平衡,此时C的浓度为1.2 mol/L。
①2分钟内用B表示的平均反应速度为 ;
②若容器温度升高,平衡时混合气体的平均摩尔质量减小,则正反应为 (填“吸热”或“放热”)反应。
(2)一定温度下,在一定容积的密闭容器中发生如下可逆反应:
2A(g)+B(g) 2C(g)
2C(g)
在反应过程中,C的物质的量n(C)随时间的变化关系如下图所示(从t1时间开始对反应体系升高温度)。
试回答下列问题:
①A点时,反应的v(正)v(逆)(填“>”、“<”或“=”);
②此反应的逆反应为 热反应(填“放”或“吸”);
③A、B两点的正反应速率:v(A)v(B)(填“>”、“<” 或“=”)。
五种短周期元素A、B、C、D、E,原子序数逐渐增大,A、B处于同一周期,C、D、E同处另一周期。C、B可按原子个数比2∶l和1∶1分别形成两种离子化合物甲和乙。A原子的最外层电子数比次外层电子数多3个。E周期序数等于E原子最外层电子数。根据以上信息回答下列问题:
(1)A、B、C、D、E五种元素的原子半径由小到大的顺序是 (用元素符号填写)
(2)乙物质中存在的化学键类型是 。
(3)选用恰当的试剂除去D中少量的E,写出发生反应的化学方程式 。
(4)化合物乙的电子式 。
(5)将D、E的单质插入NAOH溶液中,构成原电池,其负极反应是 。
按下图所示装置进行实验,并回答下列问题:
(1)判断装置的名称:A池为 ,B池为 。
(2)锌极为____极,电极反应式为 ;铜极电极反应式为 ;石墨棒C1为____极,电极反应式为 ;石墨棒C2附近的实验现象为___ _____。
(3)当C2极析出224 mL气体(标准状况下)时,锌质量 (填增加或减少),为 g;CuSO4溶液的质量 (填增加或减少),为 g。
(1)今有2H2+O2  2H2O反应,构成燃料电池,则负极通入的应是 ,正极通的应是 。电极反应式为正极: ;负极: ;
2H2O反应,构成燃料电池,则负极通入的应是 ,正极通的应是 。电极反应式为正极: ;负极: ;
(2)若把KOH溶液改为稀H2SO4作电解质,则电极反应式为
正极: ;负极: ;
(1)和(2)的电解质不同,反应后,其溶液的pH各有什么变化? ;
(3)若把H2改为CH4,用KOH溶液作电解质溶液,则负极的电极反应式为 。