下列不能作为苯分子中碳原子间的化学键是一种介于C-C和C=C之间的特殊的化学键的依据的是
| A.苯不能使溴水褪色 | B.苯不能被酸性高锰酸钾溶液褪色 |
| C.邻二甲苯没有同分异构体 | D.苯分子中6个C原子共平面 |
某化学实验兴趣小组同学向用大理石和稀盐酸制备CO2后残留液中滴加碳酸钠溶液,在溶液中插入pH传感器,测得pH变化曲线如图所示,下列有关说法不正确的是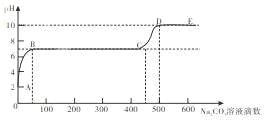
| A.开始时溶液pH=2是因为残留液中还有盐酸剩余 |
| B.AB段表示随着碳酸钠溶液的滴入,CaCO3沉淀的质量逐渐增加 |
| C.BC段发生的反应为:Ca2++CO32-= CaCO3↓ |
| D.滴入500滴碳酸钠溶液后溶液中c(OH-)>c(H+) |
工厂排放的SO2烟气对环境造成污染,某企业用下列流程综合处理,下列有关说法正确的是
| A.二氧化硫吸收塔中发生的反应为:SO2+SO32-+H2O=2HSO3- |
| B.氨气吸收塔中发生的反应为:HSO3-+OH-= H2O+SO32- |
| C.上述流程利用的是氧化还原反应原理 |
| D.上述流程可降低碳排放,符合低碳经济 |
美国科学家找到了一种突破目前锂离子电池充电量和充电速度限制的方法,该方法将硅簇置入石墨烯层之间,达到提升电池内部锂离子密度的效果,这种材料制成的新型锂电池充电容量和效率都比普通锂电池提高近十倍,下列有关说法正确的是
| A.电池工作时,锂电极为阳极,发生还原反应 |
| B.电池充电时,Li+向阴极移动 |
| C.该电池的化学能可完全转化为电能 |
| D.新材料就是碳和硅化合而成的碳化硅材料 |
催化反硝化法可治理水中硝酸盐的污染,该方法是用H2将NO3-还原为N2,反应的化学方程式为:5H2+ 2 NO3- xOH-+ N2+4H2O。下列有关说法正确的是
xOH-+ N2+4H2O。下列有关说法正确的是
| A.该反应为置换反应 |
| B.每生成1mol N2,反应转移5mole- |
| C.x=2 |
| D.反应过程中溶液pH减小 |
下列过程中的颜色变化与化学变化无关的是
| A.银白色的金属铁研磨成铁粉后变成黑色 |
| B.新切割开的金属钠的表面由银白色迅速变为暗灰色 |
| C.红棕色的NO2通过装有水的洗气瓶后得到无色气体 |
| D.浅黄绿色的新制氯水久置后变为无色 |