实验室制取气体所需的装置如下图所示。

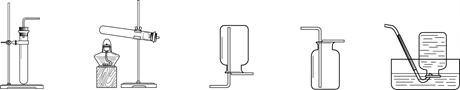
A B C D E
请回答以下问题。
(1)实验仪器a的名称是________。
(2)用过氧化氢溶液和二氧化锰制取氧气的化学方程式为______,二氧化锰起 作用。
(3)用大理石和稀盐酸制取二氧化碳的化学方程式为_____。用装置__(填字母序号)收集一瓶二氧化碳,将燃着的木条放在瓶口,若观察到_______,说明瓶中已充满二氧化碳。
化学教师为了调动同学们探究的积极性,布置了一个探究任务:粉笔的成份是初中化学中常见的盐类,请同学们探究粉笔的化学成份。某化学兴趣小组进行了以下探究实验。
【提出猜想】
(1)粉笔的成份氯化物;(2)粉笔的成份碳酸盐;(3)粉笔的成份硫酸盐。
【实验探究】
(1)取一个段白色的粉笔(约1g),在研钵中研成粉末,倒入大烧杯中,加入100mL蒸馏水充分搅拌,静置,发现烧杯底部有较多的白色回体未溶解。根据下表以及后面实验操作现象,判断粉笔的成份属于哪类物质?。
| 溶解度(20℃) |
﹤0.01g |
0.01g~1g |
1g~10g |
﹥10g |
| 物质分类 |
难溶 |
微溶 |
可溶 |
易溶 |
(2)从烧杯中取少许上层清液注入试管,滴加几滴酚酞,无明显现象。粉笔溶液(酸碱性)不可能呈性;
(3)从烧杯中取少许上层清液注入试管,滴加盐酸溶液,无明显现象产生;
(4)从烧杯中取少许上层清液注入试管,滴加Na2CO3溶液,产生白色沉淀;
(5)从烧杯中取少许上层清液注入试管,滴加BaCl2溶液,产生白色沉淀。
【实验判断】
根据探究实验中出现的现象,请你做出粉笔化学成份可能合理的判断。完成下列填空:
(6)写出粉笔的主要成份化学式;
(7)写出【实验探究】(4)中化学反应的化学方程式;
(8)写出【实验探究】(5)中化学反应的化学方程式。
化学实验室有一瓶无色透明的X溶液,其标签已脱落,某兴趣小组决定通过探究实验的方式确定其化学成份。他们取出6份X溶液,分别滴加下列6种溶液,实验现象如下表所示。请推断X可能是何物质,并写出合理的化学方程式:
| ①滴加酚酞试液,无明显现象。 |
④滴加Na2CO3溶液,产生白色↓。 |
| ②滴加HCl液液,无明显现象。 |
⑤滴加Na2SO4溶液,产生白色↓。 |
| ③滴加NaOH溶液,无明显现象。 |
⑥滴加AgNO3溶液,产生白色↓。 |
(1)写出X的化学式;
(2)写出④的化学方程式;(3)写出⑥的化学方程式。
某化学兴趣小组在做完制取二氧化碳的实验后(用石灰石和稀盐酸制取),对反应后反应器内的剩余溶液的溶质成分产生了兴趣,他们继续进行了以下实验探究。
【分析推断】根据制取二氧化碳的反应原理,可以确定剩余溶液中一定含有氯化钙。但其中是否含有氯化氢需要通过实验来证明。若剩余溶液显酸性(含有H+),说明含有氯化氢。
【查阅资料】碳酸钙不溶于水,氢氧化钙微溶于水,氯化钙溶液呈中性。
【实验过程】将剩余的溶液倒入烧杯中,微热后冷却到室温。请设计三种实验方案,用三种不同类别的物质检验烧杯中的溶液是否含有氯化氢,并根据实验过程完成下表需填写的内容。
| 实验操作 |
实验现象 |
实验结论 |
|
方案一 |
取烧杯中溶液少许于试管中,向其中滴加2至3滴紫色石蕊试液 |
溶液显酸性(含有H+);溶质中有氯化氢。 |
|
方案二 |
有气泡产生 |
||
方案三 |
【拓展提高】若要从剩余溶液中得到尽可能多的纯净的氯化钙固体,同学们认为可以向剩余溶液中加入稍过量的____________(填化学式),经____________、蒸发等操作后即可完成。
Ⅰ某化学兴趣小组对CO2是否支持常见金属的燃烧进行探究活动。
【活动】探究CO2是否支持实验室常见金属镁的燃烧
实验①:将燃着的镁条插入充满CO2的集气瓶,发现镁条仍燃烧。生成物除白色MgO外,还有一种黑色固体。
(1)镁在CO2中反应的化学方程式为;
(2)实验①的结论是,由该结论可知(写“能”或“不能”)用CO2灭火器扑灭活泼金属的火灾。
(3)通过实验①你对燃烧条件的新认识是。
Ⅱ小丽在探究碱的化学性质时,将稀盐酸滴入到氢氧化钠溶液中,意外地看到有气泡产生,她认为氢氧化钠溶液已经变质了。用化学方程式表示氢氧化钠溶液变质的原因:。
【提出问题】变质后的氢氧化钠溶液中的溶质是什么?
【猜想假设】小丽对变质后的氢氧化钠溶液中的溶质成分做出了两种猜想:
猜想一:;猜想二:;
【实验设计】为验证上述猜想哪个正确,小丽设计了如下方案:取少量氢氧化钠溶液样品于试管中,滴加几滴无色酚酞溶液,观察溶液颜色变化。
小红认为小丽的实验方案不合理,理由是:。
【实验与结论】小红另外设计并完成了实验,请你帮她填写下面的实验报告:
| 实验步骤 |
实验现象 |
结论 |
| 步骤1:取少量氢氧化钠溶液样品于试管中,向其中滴加过量的 |
猜想一 正确 |
|
| 步骤2:将步骤1试管中的混合物过滤,向滤液中滴加无色酚酞溶液 |
(1)小方用下图所示装置对二氧化碳的灭火实验进行研究,
观察到的现象是____________________________________。
实验的结论是______________________________________。
(2)【提出问题】二氧化碳能否支持燃烧?
【猜想假设】镁能在二氧化碳中燃烧。
【查阅资料】①氧化镁、氢氧化镁均是白色难溶于水的固体。
②MgO+2HCl= MgCl2+H2O 、
③MgCl2+2NaOH=Mg(OH)2↓+2NaCl 。
【实验探究】
①下图中镁带剧烈燃烧,冒白烟,有黑色固体生成,并放出大量的热。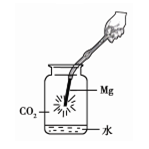
②为检验生成物的成分,做如下实验。
| 实验步骤 |
实验现象 |
实验结论和化学方程式 |
|
| 向广口瓶中加入过量盐酸,充分反应后过滤,在滤纸上留有黑色固体。 |
I、将黑色固体收集、洗涤、干燥后,点燃,在火焰上方罩一个蘸有澄清石灰水的烧杯。 |
黑色固体燃烧,烧杯内壁出现白色浑浊。 |
黑色固体是______; 反应的化学方程式是: ___________________。 |
| II、取少量滤液于试管中,逐滴加入氢氧化钠溶液。 |
开始_______,后有白色沉淀产生。 |
白烟的成分是______。 |
③为了回收II中的白色沉淀,证明沉淀完全的实验方法是______________________
___________________________________(要求写出步骤、试剂、现象和结论)。
【反思提高】实验室中由某些活泼金属引起的着火,不能用二氧化碳灭火,应用细沙灭火。