某校化学兴趣小组就空气中氧气的含量进行实验探究: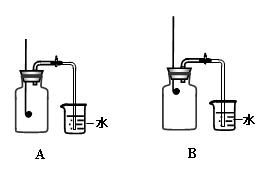
[集体讨论]
(1)讨论后同学们认为,选择的药品既要能消耗氧气,又不会跟空气中的其它成分反应,而且生成物为固体。他们应该选择(填编号) ,
A.蜡烛 B.红磷 C.硫粉
为了充分消耗容器中的氧气,药品的用量应保证 。
(2)小组同学共同设计了如上图的两套装置,你认为合理的是(填编号) 。
为了确保实验的成功,在装药品之前应该 。
[分组实验] 在讨论的基础上,他们分组进行了实验。
[数据分析] 实验结束后,整理数据如下:(注:集气瓶容积为100mL)
| 组 别 |
1 |
2 |
3 |
4 |
5 |
6 |
| 进入集气瓶中水的体积(mL) |
20 |
21 |
19 |
20 |
22 |
18 |
(3)通过对实验结果的交流,大多数同学都验证出氧气约占空气体积的 。
通过实验还可以推断集气瓶中剩余气体是 。
[实验拓展]
(4)小组的同学做完实验后又尝试用木炭重新做了以上实验,发现水几乎没有进入集气瓶。经讨论,同学们一致认为如果事先在集气瓶内注入少量碱溶液来吸收木炭燃烧产生的 气体,实验也能取得较好的效果。
碳酸氢钠是一种用途广泛的盐,某实验小组的同学设计了以下实验,以探究碳酸氢钠的性质。
【探究实验1】碳酸氢钠的物理性质:用(写仪器名称)取少量固体放入试管中,加入适量水充分振荡。现象:固体为白色粉末,加水后固体。结论:碳酸氢钠能溶于水。
【探究实验2】碳酸氢钠溶液的酸碱性:在上述溶液中滴入几滴酚酞试液,振荡。
现象:溶液变成红色。由此得出的结论是 。
【探究实验3】能否与酸反应:取少量固体放入试管中,加入稀盐酸,现象为
。结论:碳酸氢钠能与酸反应。
【探究实验4】碳酸氢钠的热稳定性:用如图所示
装置进行实验。大试管口略向下倾斜的原因是
;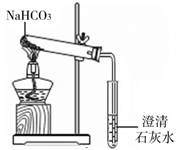
现象:充分加热后,大试管壁上有水珠出现,管底有
白色固体残留,小试管中澄清石灰石变浑浊;结论:
碳酸氢钠受热能分解,分解的反应方程式是
;
验证:请你帮他们设计实验,证明试管中留下的白色固体是Na2CO3,而不是NaOH,实验方法和现象是 。
【拓展应用】试说出碳酸氢钠在日常生活中的一种用途 。
甲同学将燃烧的钠迅速伸入到盛有纯净干燥的CO2的集气瓶中,发现金属钠在CO2中继续燃烧,燃烧停止后,在集气瓶底发现有黑色颗粒生成,瓶内壁上有白色物质生成。
(1)甲认为黑色颗粒是(用化学式填空),白色物质可能是Na2O或Na2CO3;乙同学认为白色物质还有可能是氢氧化钠固体。甲同学认为乙同学的猜想不正确,其理由是;
(2)查阅资料发现:氧化钠为白色粉末,溶于水生成氢氧化钠:Na2O+H2O=2NaOH。甲同学据此对白色物质进行了下列实验:
(3)丙同学认为方案1得到的结论不正确,理由是:
(4)钠在二氧化碳中燃烧的化学方式为:,属于基本反应类型中的反应。
在学习盐的性质时,某组同学将碳酸钠溶液和一瓶标签破损的溶液M(如图)进行反应,有白色沉淀产生,过滤后得到澄清滤液。该组同学对该实验进行了下列研究。
(1)溶液M的可能组成:
猜想①:是 ,
猜想②:是CaCl2(查资料知CaCl2水溶液呈中性)。
为了确定其组成,同学们设计了如下方案并进行实验:
| 实验操作 |
实验现象 |
实验结论 |
| 取少量M溶液于试管中,向其中滴加酚酞 |
猜想①正确 |
(2)若猜想①正确,则上述过滤后得到的澄清滤液中可能含有的溶质:
猜想一:NaOH和Na2CO3;
猜想二:;
猜想三:NaOH。设计实验方案确定滤液中溶质的组成。
| 实验操作 |
实验现象 |
实验结论 |
| 分别取少量滤液于A、B两支试管中,A中加入CaCl2溶液,B中加入 溶液 |
“猜想一”成立 |
|
| “猜想二”成立 |
||
| “猜想三”成立 |
某化学学习小组在化学药品柜中发现一瓶保管不当,标签模糊不清的无色溶液,(如图)且实验员告诉小组成员该溶液显碱性;已知这瓶溶液是以下四瓶溶液中的其中一种:H2SO4溶液、NaOH溶液、FeCl 3溶液、Na2CO3溶液。小组成员小强和小红同学很感兴趣,决定对其成分进行探究(提示:碳酸钠溶液显碱性)
(1)小强和小红根据上述信息判断,该溶液不可能是溶液和溶液;
只可能是其他两种溶液中的一种。
(2)为了进一步确定该溶液是何种溶液,请你帮小强和小红设计实验方案,叙述
实验操作、预期现象与结论。
(实验室提供必要的实验仪器,限选以下试剂:氯化钡溶液、锌粒、澄清石灰水、食盐水、稀盐酸)
| 实验操作 |
预期现象与结论 |
小强同学用三支试管,分别取适量的稀盐酸、澄清石灰水、碳酸钠溶液进行相关实验探究。
步骤1:向三支试管中分别滴加酚酞后,Na2CO3溶液中显红色,说明Na2CO3溶液显性;
步骤2:小强把三支试管中的溶液同时倒入一只烧杯中,发现有气泡产生,最终有白色沉淀生成且溶液显红色;白色沉淀为(写化学式)
步骤3:把烧杯中的混合物进行过滤,得到滤液,滤液中一定不含有________。(选填字母):
A.稀盐酸 B.澄清石灰水 C.碳酸钠溶液
[实验猜想] 步骤3所得滤液中溶质可能为:①NaCl Na2CO3;
②NaCl CaCl2和NaOH;
③NaCl Na2CO3和NaOH; ④…
[实验验证](提示:CaCl2溶液显中性)
| 实验操作 |
实验现象 |
实验结论 |
有关化学方程式 |
| 取少量滤液于试管中,加入足量CaCl2溶液 |
猜想③成立 |
[反思评价] 有同学提出将CaCl2溶液改为稀盐酸,若观察到有气泡产生且红色消失,则证明猜想③成立。你认为是否正确(填“正确或不正确”) 其理由是:。