向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是
| |
操作 |
现象 |
结论 |
| A |
滴加稀硫酸,将产生的气体通入澄清石灰水 |
石灰水变浑浊 |
原溶液中含有CO  或HCO 或HCO  |
| B |
滴加氯水和CCl ,振荡、静置 ,振荡、静置 |
下层溶液显紫色 |
原溶液中有I |
| C |
滴加盐酸酸化的BaCl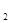 溶液 溶液 |
产生白色沉淀 |
原溶液中含有SO  |
| D |
滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 |
试纸不变蓝 |
原溶液中无NH 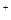 |
1956年底,社会主义制度在我国初步确立,这是20世纪中国的一次历史性巨变。最能体现这次巨变特点的是
| A.社会主义公有制主导地位的确立 | B.人民代表大会制度的确立 |
| C.外交政策发生历史性的转折 | D.过渡时期总路线的公布 |
“车轮飞转东西南北追风去,钢水奔腾春夏秋冬入眼来。”这副春联描述了我国“一五”计划期间的两项建设成就,这两项建设成就是
①长春一汽建成投产②鞍钢大型轧钢厂建成投产
③沈阳第一机床厂建成投产④大庆油田建成
| A.①④ | B.②③ | C.③④ | D.①② |
1950年,为实现“耕者有其田”,我国采取了触及“农之根本”,乃至“国之根本”的大动作。这个“大动作”指的是
| A.土地改革 | B.大跃进 |
| C.对农业的改造 | D.人民公社化 |
2014年3月28日,韩国政府向我国归还了475具志愿军烈士遗骸。60多年前率领中国人民志愿军奔赴朝鲜半岛作战的司令员是
| A.彭德怀 | B.邓小平 | C.刘伯承 | D.朱德 |
李克强总理说:“要把法律放在神圣的位置,无论任何人、办任何事,都不能超越法律的权限。”新中国成立初期起临时宪法作用的文件是
| A.《中华人民共和国土地改革法》 | B.《中华人民共和国刑法》 |
| C.《中国人民政治协商会议共同纲领》 | D.《中华人民共和国宪法》 |