已知A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素,A与B;C、D与E分别位于同一周期。A原子L层上有2对成对电子, B、C、D的核外电子排布相同的简单离子可形成一种C3DB6型离子晶体X,,CE、FA为电子数相同的离子晶体。
(1)写出A元素的基态原子价电子排布式 ;F离子电子排布式 。
(2)写出X的化学式
(3)试解释工业冶炼D不以DE3而是以D2A3为原料的原因: 。
(4)CE、FA的晶格能分别为786 KJ/mol l、3401KJ/mo,试分析导致两者晶格能差异的主要原因是: 。
(5)F与B可形成离子化合物,其晶胞结构如图所示:F与B形成离子化合物的化学式为________;该离子化合物晶体的密度为a g/cm3,则晶胞的体积是________________(只要求列出算式)。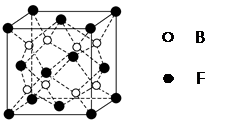
(共16分)Ⅰ.CO和H2作为重要的燃料和化工原料,有着十分广泛的应用。
(1)已知:C(s)+O2(g)=CO2(g) △H1= -393.5 kJ·mol-1
C(s)+H2O(g)= CO(g)+H2(g)△H2= +131.3 kJ·mol-1
则反应CO(g)+H2(g)+O2(g)=H2O(g)+CO2(g)△H= kJ·mol-1。
(2)利用反应CO(g) +H2(g)+O2(g) = CO2(g) +H2O(g)设计而成的MCFS燃料电池是用水煤气(CO和H2物质的量之比为1:1)作负极燃气,空气与CO2的混合气为正极助燃气,用一定比例的Li2CO3和Na2CO3低熔点混合物做电解质的一种新型电池。现以该燃料电池为电源,以石墨作电极电解饱和NaCl溶液,反应装置以及现象如图所示。则有:
①燃料电池即电源的N极的电极反应式为 _______________________;
②已知饱和食盐水的体积为1 L,一段时间后,测得左侧试管中气体体积为11.2 mL(标准状况),若电解前后溶液的体积变化忽略不计,而且电解后将溶液混合均匀,则此时溶液的pH为 。
Ⅱ.CO和NO是汽车尾气的主要污染物。消除汽车尾气的反应式之一为:
2NO(g)+2CO(g) N2(g)+2CO2(g)。请回答下列问题:
N2(g)+2CO2(g)。请回答下列问题:
(3)一定温度下,在一体积为VL的密闭容器中充人一定量的NO和CO时,反应进行到t时刻时达到平衡状态,此时n(CO)=amol、n(N0)=2amol、n(N2)=bmol,且N2占平衡混合气体总体积的1/4。
①该反应的平衡常数K=(用只含a、V的式子表示)
②判断该反应达到平衡的标志是____(填序号)
A.v(CO2)生成=v(CO)消耗
B.混合气体的平均相对分子质量不再改变
C.混合气体的密度不再改变
D.NO、CO、N2、CO2的物质的量浓度均不再变化
(4)在一定温度下,将2.0molNO、2.4molCO通入固定容积2L的密闭中,反应过程中部分物质的物质的量变化如图所示,则:
①有害气体NO的转化率是,0~15minCO2的平均反应速率v(CO2)=____(保留小数点后三位)
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件是。(填序号)。
A.增加CO的量 B.加入催化剂
C.减小CO2的量 D.扩大容器体积
(共15分)不饱和酯类化合物在药物、涂料等领域应用广泛。
(1)下列关于化合物I的说法,正确的是
| A.可能发生酯化反应和银镜反应 |
| B.1mol化合物I最多与2molNaOH反应 |
| C.与FeCl3溶液能显紫色 |
| D.能与溴发生取代和加成反应 |
(2)下面反应是一种由烯烃直接制备不饱和酯的新方法
①化合物II的分子式为。
②1mol化合物II能与molH2恰好反应生成饱和烃类化合物。
③化合物Ⅲ与足量的NaOH溶液共热的化学方程式为;反应类型:
(3)3﹣对甲苯丙烯酸甲酯(E)是一种用于合成抗血栓药的中间体,其合成路线如下:
已知:HCHO+CH3CHO CH2=CHCHO+H2O
CH2=CHCHO+H2O
①A中官能团的名称为。D中含氧官能团的名称为。
②E的结构简式为。
③试剂C可选用下列中的
a、溴水b、银氨溶液
c、酸性KMnO4溶液d、新制Cu(OH)2悬浊液
④B在一定条件下可以生成高聚物F,该反应的化学方程式为_________ 。
氮及其化合物在工农业生产、生活中有重要作用。请按要求回答下列相关问题:
(1)食品添加剂铵明矾NH4Al(SO4)2·12H2O高温可分解,下列关于其分解产物的预测不合理的是_____。
A.NH3、N2、SO2、H2O B.NH3、SO3、H2O
C.NH3、SO2、H2O D.NH3、N2、SO3、SO2、H2O
(2)汽车发动机工作时也会引发N2和O2反应产生大气污染物NO,其能量变化示意图为_____
则该反应的热化学方程式为_________________________。
(3)工业合成氨的反应:N2(g)+3H2(g) 2NH3(g) △H<0,分别在T1、T2温度下,改变起始氢气物质的量,测得平衡时氨的体积分数如图所示:
2NH3(g) △H<0,分别在T1、T2温度下,改变起始氢气物质的量,测得平衡时氨的体积分数如图所示:
①比较在m、n、q三点所处的平衡状态中,反应物N2的转化率最高的是________点。
②T2条件下,在2 L的密闭容器中,充入x mol N2和y mol H2时,3 min达平衡,此时反应物的转化率均为a,写出下列仅含a、x的表达式(不必化简):v(N2)=_______;该反应的平衡常数的值K =_______。
③图像中T2________T1(填“高于”、“低于”、“等于”或“无法确定”)。
④科学家采用高质子导电性的SCY陶瓷(能传递H+)实现氨的电化学合成,这提高了氮气和氢气的转化率。写出电化学合成过程中发生还原反应的电极方程式:___________________________________。
(4)将质量相等的四份铁粉和铜粉的均匀混合物,分别加入同浓度稀硝酸充分反应,(假设硝酸的还原产物只有NO)实验数据如下表:
| 编 号 |
① |
② |
③ |
④ |
| 稀硝酸体积/mL |
100 mL |
200 mL |
300 mL |
400 mL |
| 剩余金属/g |
18.0 g |
9.6 g |
0 |
0 |
| NO体积/L(标准状况下) |
2.24 L |
4.48 L |
6.72 L |
V |
下列有关分析推断正确的是____________。
A.硝酸起始浓度为4 mol/LB.①中溶解了5.6 g Fe
C.③中n(Cu2+) =" 0.15" mol D.④中V =" 6.72" L
钠及其化合物具有广泛的用途。
(1)工业上制备金属钠的常用方法是____________。试写出制备金属钠的化学方程式。金属钠可用于(写出Na在熔点低方面的一种用途)。
(2)用Na2CO3熔融盐作电解质,CO、O2、CO2为原料可组成新型电池。该电池的结构如图所示:
①正极的电极反应式为___________,电池工作时物质A可循环使用,A物质的化学式为_____________。
②请写出检验Na2CO3中钠元素的方法。
(3)常温下,浓度均为0.1 mol·L-1的下列五种钠盐溶液的pH如下表:
| 溶质 |
CH3COONa |
Na2CO3 |
NaClO |
NaCN |
| pH |
8.8 |
11.6 |
10.3 |
11.1 |
上述盐溶液的阴离子中,结合H+能力最强的是,根据表中数据,浓度均为0.01 mol·L-1的下列四种酸的溶液分别稀释100倍,pH变化最大的是_______(填序号)。
a.HCN b.HClO c.CH3COOHd.H2CO3
(4)实验室中常用NaOH来进行尾气处理、洗气和提纯。
①常温下,当300 mL 1 mol·L-1的NaOH溶液吸收4.48 L(折算成标准状况)SO2时,所得溶液pH>7,则溶液中各离子浓度由大到小的顺序为________________________。
②已知几种离子开始沉淀时的pH如下表:
| 离子 |
Fe2+ |
Cu2+ |
Mg2+ |
| pH |
7.6 |
5.2 |
10.4 |
当向含相同浓度Cu2+、Mg2+、Fe2+的溶液中滴加某浓度的NaOH溶液时,________(填离子符号)先沉淀,Ksp[Fe(OH)2]______Ksp[Mg(OH)2](填“>”、“=”或“<”)。
如下表所示为元素周期表的一部分,参照元素①~⑦在表中的位置,请回答下列问题:
| 族 周期 |
IA |
0 |
||||||
| 1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
| 2 |
② |
③ |
||||||
| 3 |
④ |
⑤ |
⑥ |
⑦ |
(1)③、④、⑦的原子半径由大到小的顺序为(用元素符号表示)。
(2)⑥和⑦的最高价含氧酸的酸性强弱为(用酸的化学式表示)。
(3)①、②两种元素按原子个数之比为1:1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式 ;
(4)由表中元素形成的物质可发生如图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。
①写出D溶液与G反应的化学方程式。
②写出检验A溶液中溶质的阴离子的方法。
③常温下,若电解1L0.1 mol·L-1的A溶液,一段时间后测得溶液pH为12(忽略溶液体积变化),则该电解过程中转移电子的物质的量为。
④写出过量的E与F溶液中溶质反应的离子方程式。
(5)由②、④、⑥元素组成的化合物W(在酸性溶液中发黄,W还原性较强),在溶液中易被⑦的单质氧化,该反应的离子方程式为 。