(7分)同学们在探究碱溶液与酚酞溶液作用的实验时,发现了一个意外现象:向氢氧化钠溶液中滴入酚酞溶液(如图),溶液变成了红色,但是一会儿红色就消失了。为此某化学小组的同学进行了如下探究。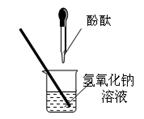
【提出猜想】甲:可能是酚酞溶液变质的缘故
乙:可能是氢氧化钠溶液与空气中二氧化碳反应的缘故
丙:可能是氢氧化钠与酚酞混合后与空气中氧气反应,使红色消失的缘故
丁:可能与氢氧化钠溶液的质量分数有关
【查阅资料】酚酞是一种常用酸碱指示剂,遇碱性溶液变红。
【讨论分析】
(1)甲同学提出猜想后,很快被小组同学否定了,其理由是 。
(2)经过思考,大家认为乙同学的猜想也不正确,其理由是 。
【实验设计】
(3)为验证丙同学的猜想是否正确,小组同学做了如下实验,请完成表中内容。
| 实验步骤 |
实验目的 |
现象结论 |
| ①用煮沸过的蒸馏水配制某氢氧化钠溶液。 |
。 |
溶液先变成红色,一会儿红色又消失。 丙同学的猜想不正确。 |
| ②取少量上述氢氧化钠溶液,滴入酚酞,然后在上方滴一些植物油。 |
。 |
(4)为验证丁同学的猜想是否正确,小组同学进行了如下实验探究,请回答有关问题。
| 实验方法 |
观察到的现象和结论 |
| 方案一:分别配制不同质量分数的氢氧化钠溶液,然后各取少量并滴加2滴酚酞溶液。 |
质量分数小的溶液中红色不消失,质量分数大的溶液中红色会消失,则证明 。 |
| 方案二: 。 |
出现红色且不褪去,结论同上。 |
【知识拓展】
⑸若将质量分数为10%和20%的氢氧化钠溶液等质量混合,所得溶液中溶质的质量分数是 。
A.10% B.15% C.20% D.30%
研究小组进行木炭还原氧化铁的探究活动。将木炭、氧化铁及试管充分烘干,并将木炭和氧化铁混合均匀、研磨。取适量上述混合物于试管中,用图1所示的装置加热(试管竖直向上,可使加热时的热量尽少散失)。

【提出问题】实验结束后,试管中的剩余固体X含有哪些成分,质量分别是多少?
【查阅资料】
铁的氧化物被还原时,是从高价铁的氧化物逐级还原成低价铁的氧化物,最后还原成金属铁。铁的氧化物及其部分性质如下: 为红色固体;
为红色固体;  和
和 均为黑色固体。其中,
均为黑色固体。其中, 具有很好的磁性,能被磁铁吸引。三种氧化物均不溶于水,但能溶于稀盐酸,分别发生如下反应:
具有很好的磁性,能被磁铁吸引。三种氧化物均不溶于水,但能溶于稀盐酸,分别发生如下反应:
Fe2O3+6HCl ══ 2FeCl3+3H₂O
Fe3O4+8HCl ══ 2FeCl3+FeCl2+4H2O
FeO+2HCl ══ FeCl2 + H2O
黄色的 溶液中滴入无色的KSCN溶液,溶液变为红色,该实验常用于检验
溶液中滴入无色的KSCN溶液,溶液变为红色,该实验常用于检验 ;
; 溶液遇单质铁发生反应:2FeCl3 + Fe = 3FeCl2,溶液变为浅绿色。
溶液遇单质铁发生反应:2FeCl3 + Fe = 3FeCl2,溶液变为浅绿色。
【猜想】固体X可能含有:① ②
② ③
③ ④⑤
④⑤
【实施实验】
目的:确定固体X的组成。
| 步骤 |
操作 |
主要现象 |
结论 |
| I |
取部分冷却后的固体X倒在滤纸上,用磁铁充分吸引。 |
部分固体被吸引到磁铁上 |
可能有 或 或 |
| II |
取滤纸上的剩余固体少量,放入图2所示的试管a中,通入氧气,用酒精灯加热。 |
固体剧烈燃烧, b中溶液变浑浊 |
一定有 |
| III |
另取滤纸上的剩余固体少量,放入试管中,加入足量的稀盐酸。 |
无明显现象 |
一定没有 |
| IV |
取步骤I磁铁上的固体少量,放入试管中,逐滴加入稀盐酸。 |
产生。 |
一定有 |
| V |
在步骤IV所得溶液中逐滴加入。 |
溶液不变红色 |
一定没有 |
【反思改进】
同学们讨论发现,用上述实验方法不能确定固体X中一定没有 ,理由是。
,理由是。
为确定固体X中是否含Fe3O4并测定其中各成分的质量,同学们又进行了以下实验:
| 步骤 |
操作 |
数据 |
| I |
重新取部分冷却至室温的固体X,称量其质量为m1。 |
m1 =" 17.9" g |
| II |
将称量好的固体X全部放入图3所示的锥形瓶中,称量整套装置及药品的质量为m2;打开分液漏斗旋塞,放入足量稀盐酸后关闭旋塞,待没有气泡产生并恢复至室温,再次称量整套装置及药品的质量为m3。 |
m2 =" 317.9" g m3 = 317.3.g |
| III |
将锥形瓶中剩余的固体过滤、洗涤并干燥,称量其质量为m4。 |
m4 =" 1.1" g |
【获得结论】
(1)为确定固体X中是否含 ,m1~m4中应该用到的数据有。
,m1~m4中应该用到的数据有。
(2)固体X的成分及质量分别是。
小红同学为探究R、X、Y和Z四种金属的活动性顺序,进行以下实验。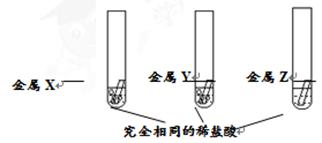
(1)将红色金属R在石棉网上加热,观察到,证明R是铜。
(2)如上图所示,将X、Y和Z分别加入三份完全相同的稀盐酸中,观察到金属X、Y的试管中均有气泡产生,金属Z的试管中无明显现象。
①金属X的试管中,最终还能观察到溶液变为浅绿色,证明X为。
②金属Y可能是(填字母序号)。
| A.Mg | B.Ag | C.Hg | D.Zn |
③四种金属中,在金属活动性顺序表中位于氢后的是,为进一步确定位于氢后金属的活动性相对强弱,还应补充的实验方案为__________(试剂可自选)。
质量守恒定律是化学反应遵循的普遍规律。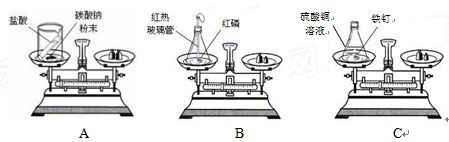
|
某同学在电视寻宝节目中,看到一些铜制文物上有绿色的锈迹,并对绿色锈迹产生了探究兴趣。
【查阅资料】①绿色锈迹是碱式碳酸铜[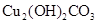 ],受热易分解。
],受热易分解。
②无水硫酸铜为白色粉末,遇水变蓝。
③碱石灰是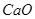 和
和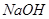 的固体混合物,
的固体混合物,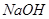 与
与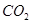 反应生成碳酸钠固体和水。
反应生成碳酸钠固体和水。
④氧化铜与稀硫酸反应生成蓝色溶液,碳粉不与稀硫酸反应也不溶解在稀硫酸中。
【发现问题】
查阅资料后,该同学将少量碱式碳酸铜放入试管中加热,发现试管中的固体由绿色变成黑色,同时试管壁
上有无色液滴生成。为了进一步确定碱式碳酸铜受热分解的产物,进行了如下探究:
探究一:碱式碳酸铜受热分解生成的黑色固体的成分。
【猜想与假设】该黑色固体可能是①碳粉;②;③碳和氧化铜的混合物。
【设计方案】请帮助该同学完成下述实验报告。
| 实验操作与现象 |
实验结论 |
| 猜想②正确 |
探究二:碱式碳酸铜受热分解还会生成CO2和H2O。
【进行实验】选择如下图所示装置进行验证。
步骤一:连接A和B,打开活塞,通入一段时间的空气。
步骤二,关闭活塞,依次连接装置A→B→→(填“C”、“D”)。
步骤三:点燃酒精灯,观察到明显现象后,停止加热。
【解释与结论】
①当观察到,说明碱式碳酸铜受热分解生成了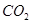 和
和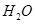 ,写出C中反应的化学方程式。
,写出C中反应的化学方程式。
②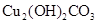 受热分解的化学方程式。
受热分解的化学方程式。
【反思与评价】
上述装置中A的作用是。
兴趣小组设计了测定空气中氧气含量的两套实验装置,请结合图示回答问题(装置气密性良好,注射器的摩擦力忽略不计)。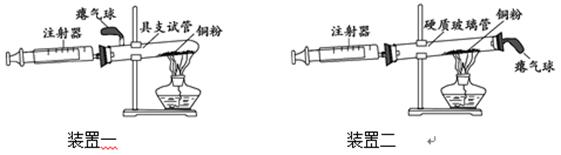
(1)装置一和装置二中气球的位置不同,(填“装置一”或“装置二”)更合理,理由是.
(2)利用合理装置进行实验,记录数据如下。
| 盛有铜粉的仪器中空气体积 |
反应前注射器中空气体积 |
反复推拉注射器,当气球恢复原状时,停止推拉并熄灭酒精灯。观察注射器中气体体积 |
| 25mL |
15mL |
9mL |
分析数据,实验测得空气中氧气的体积分数是。
(3)实验测得的结果出现偏差的原因可能是、.