溶液中只含K+、Fe2+、Cl-、SO42-四种离子.已知K+、Fe2+、Cl-的个数比为3:2:1,则溶液中Fe2+与SO42-的个数比为
| A.2:3 | B.1:4 | C.1:1 | D.3:2 |
有机物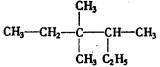 的正确命名为()
的正确命名为()
| A.2—乙基-3,3—二甲基—4—乙基戊烷 |
| B.3,3—二甲基—4—乙基已皖 |
| C.3,3,4--甲基已烷 |
| D.2,3,3-三甲基已烷 |
下列有关物质结构的表述正确的是()
| A.氧化铝的分子式Al2O3 |
B.CO2的电子式: |
| C.硫原子的最外层电子轨道表示式3s23p4 |
D.Cl-的结构示意图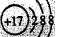 |
下列做法不能体现低碳生活的是()
| A.尽量购买本地的、当季的食物 |
| B.用石油液化气代替天然气 |
| C.瑞士馆用大豆纤维制成的红色幕帷,能发电,可天然降解 |
| D.零排放的燃料电池汽车 |
有一无色溶液,可能含有K+、Al3+、Mg2+、NH4+、Cl-、SO42-、CO32-、MnO4-中的几种。为确定其成分,做如下实验:①取部分溶液,加入适量Na2O2固体,产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生。下列推断不正确的是()
| A.肯定没有NH4+、CO32-、MnO4- | B.可能有K+、Cl- |
| C.肯定有Al3+、Mg2+、SO42- | D.可能有K+、Cl-、CO32- |
某氯化镁溶液的密度为1.1g/cm3,其中镁离子的质量分数为2.4%,300mL该溶液中Cl-离子的物质的量约等于()
| A.1.5mol | B.1.32mol | C.0.66mol | D.0.33mol |