已知可逆反应N2O4(g) 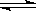 2NO2(g) 在873K时,平衡常数K1=1.78×104,转化率为a%,在1273 K时,平衡常数K2 = 2.8×104,转化率为b%,则下列叙述正确的是
2NO2(g) 在873K时,平衡常数K1=1.78×104,转化率为a%,在1273 K时,平衡常数K2 = 2.8×104,转化率为b%,则下列叙述正确的是
| A.由于K2>K1,所以a>b |
| B.由于K随温度升高而增大,所以此反应的△H>0 |
| C.由于K随温度升高而增大,所以此反应的△H<0 |
| D.其它条件不变时,将盛有该混合气体的容器置于热水中,体系颜色变浅 |
下列离子方程式书写正确是
| A.氯化亚铁溶液中加入硝酸:3Fe2++4H++NO3-=3Fe3++2H2O+NO↑ |
| B.氯化铁溶液中通入硫化氢气体:2Fe3++S2-=2Fe2++S↓ |
| C.次氯酸钙溶液中通入过量二氧化碳:Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO |
| D.碳酸氢钙溶液中加入过量的氢氧化钠溶液:Ca2++HCO3—+OH-=CaCO3↓+H2O: |
用NA表示阿伏伽德罗常数的值,下列说法正确的是
| A.NO2和H2O反应毎生成2mol HNO3时转移的电子数目为2NA |
| B.1mol苯分子中含有3NA个碳碳单键 |
| C.24g NaH中阴离子所含电子总数为NA |
| D.在0.1mol/LK2CO3溶液中,阴离子数目大于0.1NA |
有一瓶14%KOH溶液,加热蒸发掉100g水后,变为28%的KOH溶液80mL(蒸发过程中无溶质析出)。这80mL溶液的物质的量的浓度为
| A.6.25mol/L | B.6mol/L | C.5mol/L | D.6.75mol/L |
同温同压下,xg甲气体和yg乙气体占有相同的体积,根据阿伏加德罗定律判断下列叙述错误的是
| A.x:y等于甲与乙的相对分子质量之比 |
| B.x:y等于甲与乙的分子个数之比 |
| C.x:y等于同温同压下甲与乙的密度之比 |
| D.y:x等于同温同体积下,等质量的甲与乙的压强之比 |
某气体的摩尔质量为Mg/mol,NA表示阿伏加德罗常数的值,在一定的温度和压强下,体积为VL的该气体所含有的分子数为X,则 表示的是
表示的是
| A.VL该气体的质量(以g为单位) |
| B.1L该气体的质量(以g为单位) |
| C.1mol该气体的体积(以L为单位) |
| D.1L该气体中所含的分子数 |