黄铜是由铜和锌所组成的合金,用途广泛。某兴趣小组为探究黄铜合金的组成,取20.00 g粉末状黄铜合金样品,把60.00 g稀硫酸平均分成三等份,分三次加入样品中,均有气体产生,充分反应后,过滤出固体,将其洗涤、干燥、称量,得实验数据如下:
| |
第一次 |
第二次 |
第三次 |
| 剩余固体的质量/g |
16.75 |
13.50 |
12.40 |
请计算:(要求写出计算过程)
(1)该黄铜合金中,锌元素的质量分数。
(2)第二次实验中放出气体的质量。
(3)向三次实验后所得混合溶液中滴加BaCl2溶液,生成不溶于水的BaSO4白色沉淀。所得沉淀的质量与BaCl2溶液质量的关系如右图所示,求所用BaCl2溶液的溶质质量分数。 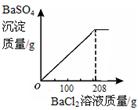
2021年3月,中央财经会议明确把碳达峰、碳中和纳入生态文明建设整体布局,争取在2060年前实现碳中和。“碳中和”是指在一定时间内产生的二氧化碳排放总量,通过二氧化碳去除手段来抵消掉这部分碳排放,达到“净零排放”的目的。
(1)二氧化碳是引起温室效应的主要气体,根据图甲回答支持这一结论的信息是: 。
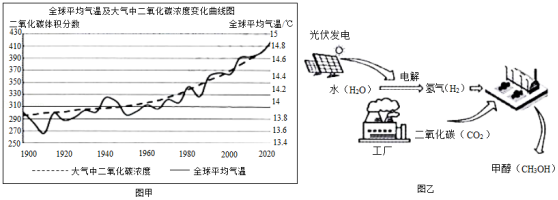
(2)科学家已经研究出多种方式来实现二氧化碳的转化。
①固碳的另一种方法是将收集的二氧化碳和水混合后注入地下玄武岩中,最终与岩石中的矿物质作用形成固态的石头碳酸盐。这种固碳方式属于 变化(选填“物理”或“化学”)。
②我国研发的“液态太阳燃料合成技术”(图乙),甲醇(CH3OH)等液体燃料被形象地称为“液态阳光”。甲醇制取过程中能量转化是:太阳能→电能→ 能。甲醇合成时,若碳元素全部来自于二氧化碳,则制取10吨甲醇需要消耗二氧化碳 吨。
(二氧化碳转化成甲醇的方程式为:CO2+3H2 CH3OH+H2O)
CH3OH+H2O)
取敞口放置的氢氧化钠溶液于烧杯中,倒入一定量的稀硫酸充分反应。为探究反应后所得溶液X的成分,兴趣小组进行了如图实验(所加试剂均足量):
(1)过滤中玻璃棒的作用是 。
(2)产生的无色气体是 。
(3)溶液X的溶质是 。
(4)计算滤液A中氯化钠的质量。

小宁用稀盐酸和石灰石反应制取二氧化碳(石灰石中的杂质既不溶于水也不和酸反应),为了探究反应后溶液的成分,他又进行如下实验:取反应后的溶液50g于烧杯中,逐滴滴入碳酸钠溶液,发现先有气泡产生,后生成白色沉淀。下表为产生的气体总质量、沉淀总质量与滴入碳酸钠溶液总质量的关系。
|
碳酸钠溶液总质量/g |
25.0 |
50.0 |
75.0 |
100.0 |
125.0 |
150.0 |
175.0 |
200.0 |
|
气体总质量/g |
1.1 |
2.2 |
2.2 |
2.2 |
2.2 |
2.2 |
2.2 |
2.2 |
|
沉淀总质量/g |
0 |
0 |
2.5 |
5.0 |
m |
n |
9.0 |
9.0 |
(1)表中n= 。
(2)所取的反应后50g溶液中溶质是 。
(3)所用碳酸钠溶液中溶质的质量分数是多少?
“青团”是宁波的一种传统食物。在“青团”制作过程中,需要往糯米粉中添加艾草(或艾草汁)。艾草含有侧柏莲酮芳香油(C10H10O),侧柏莲酮芳香油是一种淡黄色液体,具有香脂香气,所以“青团”具有独特风味。
(1)侧柏莲酮芳香油由 种元素组成。
(2)7.3g侧柏莲酮芳香油中碳元素的质量为 g。
(3)侧柏莲酮芳香油在氧气中完全燃烧的产物是 。
氯可形成多种含氯酸盐,广泛应用于杀菌、消毒及化工领域。实验室中制备KClO3的化学反应方程式为3Cl2+6KOH 5KCl+KClO3+3H2O。若用Cl2与200g的KOH溶液恰好完全反应,反应后溶液质量为221.3g。计算:
5KCl+KClO3+3H2O。若用Cl2与200g的KOH溶液恰好完全反应,反应后溶液质量为221.3g。计算:
(1)参加反应的氯气的质量为 g。
(2)所用KOH溶液中溶质的质量分数是多少?