铁及其化合物在生产、生活中应用广泛。
(1)一定条件下,Fe与CO2可发生反应:
2Fe(s)+3CO2(g) Fe2O3(s)+3CO(g)
Fe2O3(s)+3CO(g)
该反应的平衡常数(K ) 随温度(T ) 升高而增大。
①该反应的平衡常数K= ______。(填表达式)
②下列措施中,能使平衡时c(CO)/c(CO2) 增大的是 (填标号)。
| A.升高温度 | B.增大压强 |
| C.充入一定量CO | D.再加一些铁粉 |
(2)图1装置发生反应的离子方程式为 。
(3)图2装置中甲烧杯盛放100 mL 0.2 mol/L的NaCl溶液,乙烧杯盛放100 mL 0.5 mol/L的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞溶液,观察到石墨电极附近首先变红。
① 电源的M端为 极,甲烧杯中铁电极的电极反应为 。
② 乙烧杯中电解反应的化学方程式为 。
③ 停止电解,取出Cu电极,洗涤、干燥、称量、电极增重 0.64 g,甲烧杯中产生的气体标准状况下体积为 mL 。
下图是用铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极)。
已知:铅蓄电池在放电时发生下列电极反应
负极 Pb+ -2e-===PbSO4
-2e-===PbSO4
正极 PbO2+4H++ +2e-===PbSO4+2H2O
+2e-===PbSO4+2H2O
(1)请写出电解饱和食盐水的化学方程式。
(2)若在电解池中C极一侧滴2滴酚酞试液,电解一段时间后未呈红色,说明蓄电池的A极为________极。
(3)用铅蓄电池电解1 L饱和食盐水(食盐水足量、密度为1.15 g·cm-3)时,
①若收集到11.2 L(标准状况下)氯气,则至少转移电子________mol。
②若蓄电池消耗H2SO4 2 mol,则可收集到H2的体积(标准状况下)为________L。
甲、乙、丙为常见单质,乙、丙两元素在周期表中位于同一主族。X、A、B、C、D、E、F、G均为常见的化合物,其中A和X的摩尔质量相同,A、G的焰色反应为黄色。在一定条件下,各物质相互转化关系如图。
请回答:
(1) 写化学式:丙_________,E________。
(2)X的电子式为____________________。
(3) 写出A与H2O反应的化学反应方程式:__________________________ 。
(4)写出B与G溶液反应生成F的离子方程式:________________________。
(5)在上图的反应中,不属于氧化还原反应的是(填序号)______________。
2005年的诺贝尔化学奖颁给在烯烃复分解反应研究方面做出突出贡献的化学家。烯烃复分解是指在催化条件下实现C=C双键断裂两边基团换位的反应。如图表示两个丙烯分子进行烯烃换位,生成两个新的烯烃分子:2—丁烯和乙烯。
现以丙烯为原料,可以分别合成重要的化工原料I和G,I和G在不同条件下反应可生成多种化工产品,如环酯J;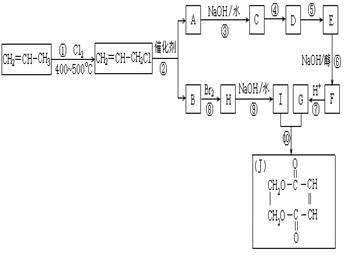
(1)G的结构简式:______________;
(2)反应②的化学方程式是___________________________________________;
(3)反应④中C与HCl气体在一定条件只发生加成反应,反应④和⑤不能调换的原因是___________________________________,E的结构简式:_____________;
(4)反应⑨的化学方程式:___________________________________________。
化合物A最早发现于酸牛奶中,它是内糖代谢的中间体,可由马铃薯、玉米淀粉等发酵制得,A的钙盐是人们喜爱的补钙剂之一。A在某种催化剂的存在下进行氧化,其产物不能发生银镜反应。在浓硫酸存在下,A可发生如下图所示的反应。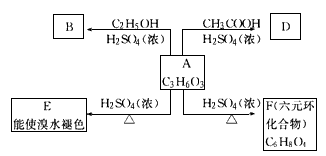
试写出:
(1)化合物A含有的官能团的名称: ___________________________
(2)化合物的结构简式: B _________ D _________
(3)化学方程式:A E __________ A
E __________ A F ____________
F ____________
(4)反应类型:A E __________,A
E __________,A F ___________
F ___________
质子核磁共振谱(PMR)是研究有机物结构的重要方法之一。在研究的化合物分子中:所处环境完全相同的氢原子在PMR谱中出现同一种信号峰:如(CH3)2CHCH2CH3在PMR谱中有四种信号峰。又如CH3-CHBr=CHX存在着如下的两种不同空间结构: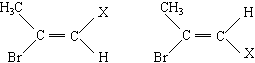
因此CH3-CHBr=CHX的PMR谱上会出现氢原子的四种不同信号峰。
请填写下列空白:
(1)化学式为C3H6O2的物质在PMR谱上观察到下列两种情况下氢原子给出的信号峰:第一种情况出现两个信号峰,第二种情况出现三个信号峰,由此可推断对应于这两种情况该有机物质结构简式可能为:;
(2)测定CH3CH=CHCl时:能得到氢原子给出的信号峰6种:由此可推断该有机物结构式为:_____________________。