钠和铜的单质及其化合物在社会实际中有着广泛的应用。
(1)Cu2+基态的核外电子排布式为_______________。
(2)NaCl晶体的晶胞结构如图所示,在NaCl的晶胞中含有的阴离子的个数为________,阳离子的配位数为________。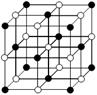
(3)钠的有关卤化物的熔点见下表,钠的卤化物熔点按NaF、NaCl、NaBr、NaI顺序降低的原因是______________。
| |
NaF |
NaCl |
NaBr |
NaI |
| 熔点/℃ |
993 |
801 |
747 |
661 |
(4)碘化钠溶液和硫酸铜溶液能反应生成一种铜的碘化物A(白色沉淀,,A的晶胞如图所示,则A的化学式是______________,A中铜元素的化合价为_____________。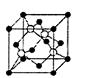
(1)某化学反应可用下式表示:A + B ="=" C + D + H2O ,若A、D均可用于消毒,且C是家家户户的厨房必备的物质之一,写出该反应的离子方程式:
(2)硝酸铅的稀溶液中,滴入几滴稀 生成白色
生成白色 沉淀,再滴入数滴饱和NaAc溶液,微热,并不断搅动,沉淀慢慢溶解,以上发生的都是复分解反应,写出反应过程的离子方程式①②
沉淀,再滴入数滴饱和NaAc溶液,微热,并不断搅动,沉淀慢慢溶解,以上发生的都是复分解反应,写出反应过程的离子方程式①②
(3)边微热边向铵明矾[NH4Al(SO4)2`12H2O]溶液中逐滴加入 溶液至中性(提示:NH+ 4、Al3+恰好完全反应)
溶液至中性(提示:NH+ 4、Al3+恰好完全反应)
①此时发生反应的离子方程式为
②向以上所得中性溶液中继续滴加稀硫酸,相关反应的离子方程式是:
⑴写出下列物质的电离方程式:
①CuCl2②Na HCO3
HCO3
③KHSO4
⑵按要求写出下列反应的离子方程式
①氢氧化铜溶于盐酸
②硫酸镁溶液中滴加氢氧化钡溶液
⑶写出与离子反应方程式CO2+2OH-=CO32-+H2O所对应的其中一个化学方程式
用浓盐酸来制取氯气的化学方程式如下:2KMnO4 +16HCl ="2KCl" +2MnCl2 + 5Cl2↑+8H2O,其中被还原的元素是,被氧化的元素是,氧化剂是 ,还原剂是,氧化产物是,还原产物是,假如有2.5 molCl2生成,则该反应中电子转移数目为___________________。
,还原剂是,氧化产物是,还原产物是,假如有2.5 molCl2生成,则该反应中电子转移数目为___________________。
现有以下物质:①NaCl晶体②液态SO3③液氯④铜⑤BaSO4固体⑥纯蔗糖(C12H22O11)⑦酒精(C2H5OH)⑧熔化的KNO3⑨盐酸⑩NH3
请回答下列问题(用序号填空):
⑴以上物质中能导电的是_________________。
⑵以上物质中属于电解质的是___________________。
⑶以上物质中属于非电解质的是____________________。
⑷以上物质中溶于水后形成的水溶液能导电的是_____________。
(1)常温下,将1 mL pH=1的H2SO4溶液加水稀释到100 mL,稀释后的溶液中=。
(2)某温度时,测得0. 01 mol·L-1的NaOH溶液的pH为11,则在该温度下水的离子积常数KW=_,该温度25℃。
01 mol·L-1的NaOH溶液的pH为11,则在该温度下水的离子积常数KW=_,该温度25℃。
(3)常温下,pH=13的Ba(OH)2溶液aL与 pH=3的H2SO4溶液bL混合(混合后溶液体积变化忽略不计)。
pH=3的H2SO4溶液bL混合(混合后溶液体积变化忽略不计)。
若所得混合溶液呈中性,则a∶b=
若所得混合溶液pH=12,则a∶b=
(4)在(2)所述温度下,将pH=a的NaOH溶液VaL与pH=b的硫酸VbL混合。
若所得混合液为中性,且a=12,b=2,则Va∶Vb=
若所得混合液的pH=10,且a=12,b=2,则Va∶Vb=